
专家简介

胡学飞 教授
上海市肺科医院胸外科主任医师、医学博士、博士生导师
中国临床肿瘤学会微创外科专委会委员
上海市医学会肿瘤靶分子专委会青委委员
上海医药行业协会规范化诊治专业委员会委员
中华医学会结核病学分会胸外科专委会委员
中国医药教育协会智能医学专业委员会胸部肿瘤精准与智能诊疗分会常委
欧洲胸外科医师学会(ESTS)会员
上海市医师志愿者联盟高级别专家
同济大学医护联合会理事
上海市青年五四奖章
日喀则人民医院最佳援藏干部
上海市肺科医院优秀医师奖 优秀党员
上海市第三十五届优秀发明选拔赛 优秀发明金奖
2021全国精英赛手术视频肺段组上海、华东、全国第一名
发表论文30余篇,其中SCI论文21篇;参编专著5部。参与、主持国自然和市科委课题4项
肺癌长期位居全球所有恶性肿瘤死亡原因的首位,其严峻的公共卫生挑战亟待重视。全球每年新增肺癌约248万例,死亡约180万。而在中国,这一数字更为沉重——每年新发肺癌约100万例,死亡约73.3万例,占全球近二分之一,发病率与死亡率双双居全国第一。其中,非小细胞肺癌(non-small cell lung cancer,NSCLC)作为肺癌的主要病理亚型,占肺癌病例的约85%,鳞状NSCLC约占30%~35%,约70%患者确诊时已经属于晚期,5年生存率不到10%。因此,探索和实施更有效的治疗策略对于提高肺癌患者的生存率和生活质量至关重要。本文旨在总结2025年NSCLC外科治疗领域的最新进展,以期为NSCLC患者的精准治疗提供新的思路与策略。
1 2025NSCLC手术技术的进展
1.1 亚肺叶切除的循证证据
一项发表于《新英格兰医学杂志》的多中心、随机、非劣效性3期临床试验(CALGB/Alliance 140503),旨在比较亚肺叶切除(包括肺段切除和楔形切除)与肺叶切除对于外周型、肿瘤直径≤2 cm、淋巴结阴性的IA期非小细胞肺癌(NSCLC)患者的疗效。研究共纳入697例患者,随机分配至亚肺叶切除组(340例)或肺叶切除组(357例)。经过中位7年的随访,结果显示亚肺叶切除在主要终点无病生存期(DFS)上不劣于肺叶切除(风险比HR=1.01;90%CI, 0.83–1.24),两组5年DFS率分别为63.6%和64.1%;总生存期(OS)亦无显著差异(HR=0.95;95%CI, 0.72–1.26),5年OS率分别为80.3%和78.9%[1]。亚组分析显示治疗效果在不同人群(如年龄、肿瘤大小、组织学类型等)中保持一致。复发模式分析表明,亚肺叶切除组的局部复发率略高(13.4% vs. 10.0%),但远处转移和新发肺癌发生率相近,总体复发风险无显著差异。此外,亚肺叶切除组在术后6个月的肺功能(FEV1)下降幅度小于肺叶切除组(-4% vs. -6%),显示其更好的功能保留效果。研究结论确认,对于严格筛选的早期NSCLC患者,亚肺叶切除是一种有效的替代方案,其肿瘤学结局与肺叶切除相当,同时可能更好地保留肺功能,这一发现为临床实践提供了重要依据,并与日本JCOG0802试验的结果相互印证。
1.2 VATS和RATS:机器人手术的突破性应用
多年来,肺癌治疗的外科技术取得了显著进步。过去需要开胸手术的疾病状况,如今可通过微创手术(MIS)进行,比如电视辅助胸腔镜手术(VATS)和机器人辅助胸腔手术(RATS)。VATS使得通过小切口进行大范围肺切除成为可能。
VATS:美国纪念斯隆-凯特琳癌症中心的Ngoc-Quynh Chu专家团队的一项回顾性研究纳入新辅助全身治疗后接受肺癌切除术、且未接受放疗的临床ⅠB~ⅢB期NSCLC患者627例[2]。在627例符合条件的患者中,360例(57%)接受了开放手术,267例(43%)接受了MIS手术。大多数患者(79.1%)接受了铂类新辅助化疗,21.9%的患者接受了免疫治疗或靶向治疗,或联合化疗。在MIS切除术中,179例(67%)通过VATS进行,88例(33%)通过RATS进行。转化率为16%(n=43)。77%的患者成功实现了MIS切除。UVA表明,治疗前临床N分期是成功的重要决定因素,但治疗前临床T分期或新辅助治疗类型并非如此。此研究证实:临床ⅠB~ⅢB期NSCLC在新辅助治疗后可成功完成MIS;治疗前存在淋巴结病变,尤其是肺门淋巴结(临床N1)病变与较高的开放手术转化率相关。
与开胸手术相比,VATS能够降低围手术期发病率,并且在肿瘤学和生存率方面取得相似的效果[2]。VATS可减少出血量、减轻炎症反应、改善术后疼痛,并降低围手术期并发症(如肺炎和心房颤动)的发生率。因此,患者住院时间缩短,恢复速度加快。
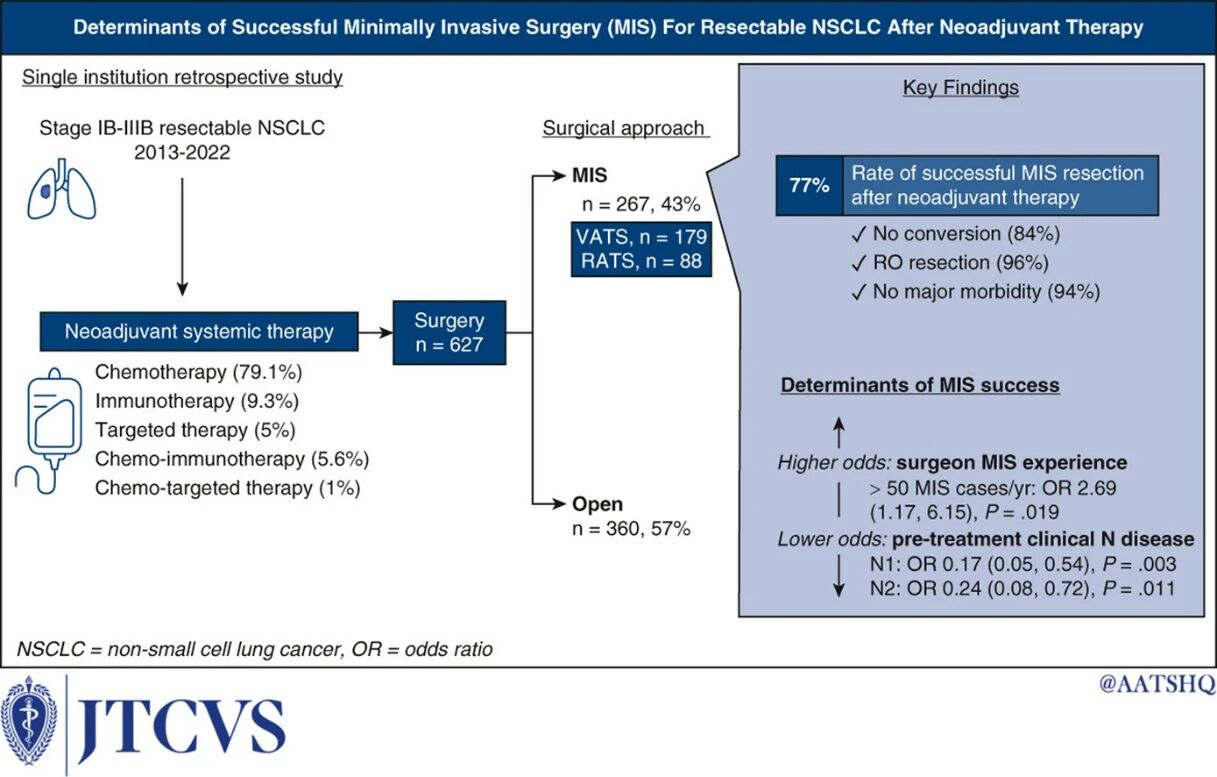
图1:MIS手术与传统开胸手术对比
RATS:RATS能为手术医生提供更灵活的操作、更佳的三维可视化效果以及更舒适的体位。RATS肺叶切除术与VATS肺叶切除术的围手术期结果相比,肿瘤学结果和OS率相似。一项由上海交通大学医学院附属瑞金医院开展的RVlob试验是首个比较机器人辅助肺叶切除术(RATS/RAL)与电视辅助胸腔镜肺叶切除术(VATS/VAL)治疗可切除非小细胞肺癌(NSCLC)长期生存结局的前瞻性随机对照试验[3]。该单中心、开放标签、非劣效性研究将320例患者按1:1随机分配至RAL组(157例)或VAL组(163例),中位随访58个月后,结果显示RAL组3年OS率为94.6%,VAL组为91.5%,绝对差异2.96%(单侧90%CI, -1.39%至∞),达到预设的非劣效界值(-5%),证实RAL在OS上不劣于VAL(HR=0.65; 95%CI, 0.33–1.28; P=0.21)。两组3年DFS率无显著差异(RAL 88.7% vs. VAL 85.4%; HR=0.87; 95%CI, 0.50–1.52; P=0.62),且复发模式与术后并发症发生率相似。
研究结论表明,RAL是可切除NSCLC的有效替代术式,其肿瘤学疗效与VAL相当,然而,由于可视化效果增强以及三维操作的灵活性,机器人辅助手术系统在处理肿瘤位于解剖结构复杂位置或组织层面难以分离的复杂病例时具有独特的优势。
2 2025NSCLC围手术期免疫治疗的进展
手术是早期NSCLC的重要治疗手段。然而,术后复发和转移风险较高,围术期治疗(包括新辅助和辅助治疗)成为改善预后的关键。近年来,免疫检查点抑制剂(如PD-1/PD-L1抑制剂)在NSCLC围术期治疗中取得突破性进展,显著提高了病理缓解率和生存率。其理论基石在于,原发肿瘤的存在能提供丰富的肿瘤抗原,可能引发比辅助治疗(仅针对微转移灶)更强大、更广泛的抗肿瘤免疫应答。
2.1 新辅助免疫治疗研究进展
新辅助免疫治疗指术前给予免疫治疗,旨在缩小肿瘤、提高手术切除率并清除微小残留病灶。多项Ⅲ期随机对照试验证实了其疗效:
CheckMate 816研究:首次证实新辅助纳武利尤单抗联合化疗对比单纯化疗可显著提高病理完全缓解(pCR)率(24% vs. 2.2%)和主要病理缓解(MPR)率(36.9% vs. 8.9%),中位无事件生存期(EFS)延长至31.6个月(对照组20.8个月),5年OS率提高至65.4%(对照组55.0%)。pCR患者5年OS率达95.3%[4]。
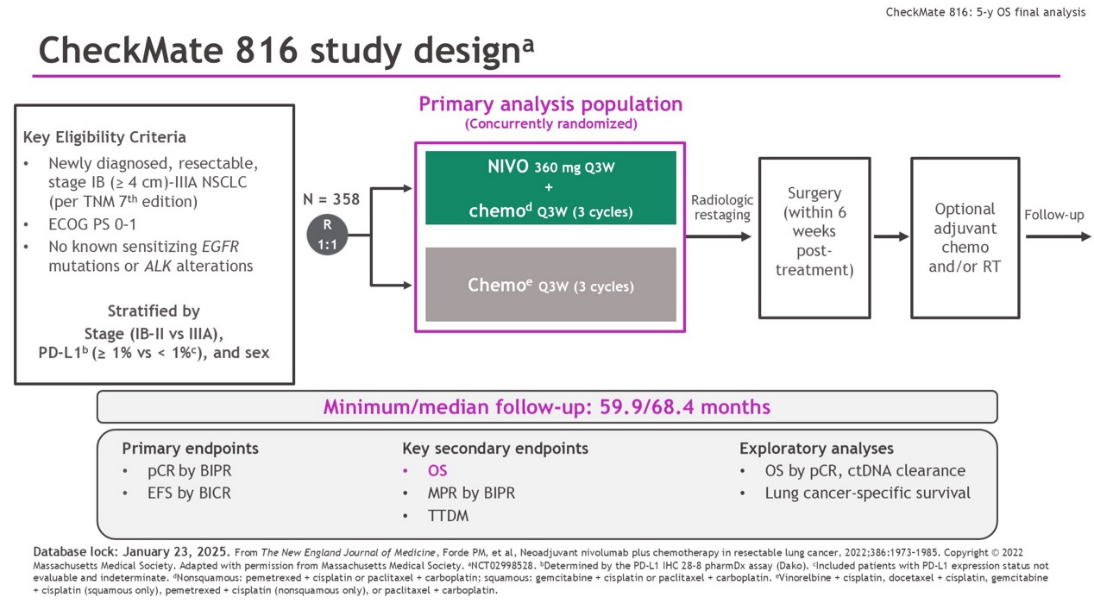
图2:CheckMate 816研究设计
KEYNOTE-671研究:评估帕博利珠单抗联合化疗的围术期模式,新辅助阶段pCR率达18.1%,辅助阶段进一步改善EFS(中位EFS 47.2个月 vs. 18.3个月)[5]。
国产PD-1抑制剂研究:如Neotorch(特瑞普利单抗)和RATIONALE-315(替雷利珠单抗)显示pCR率分别达24.8%和40.7%,MPR率分别为48.5%和56.2%,EFS显著获益[6]。
这些研究确立了新辅助免疫联合化疗作为可切除NSCLC的标准方案之一,并被FDA和NMPA批准应用。
2.2 辅助免疫治疗研究进展
辅助免疫治疗用于术后清除残留病灶,降低复发风险:
IMpower010研究:首次证实辅助阿替利珠单抗可改善PD-L1≥1%的II–IIIA期患者DFS,5年OS有延长趋势[7]。
KEYNOTE-091研究:帕博利珠单辅助治疗在全人群(包括PD-L1阴性)中降低复发风险24%,DFS获益不受PD-L1表达影响[8]。
辅助免疫治疗已成为II–III期NSCLC术后标准治疗,尤其适用于PD-L1阳性患者。
2.3 围术期免疫治疗模式
围术期模式(新辅助+辅助)进一步优化疗效:
AEGEAN研究:度伐利尤单抗新辅助联合辅助治疗,pCR率达17.2%,EFS显著改善(12个月EFS率 73.4% vs. 64.5%)[9]。
CheckMate 77T研究:纳武利尤单抗围术期治疗对比单纯新辅助方案,EFS风险降低39%,pCR率提升至25.3%[10]。
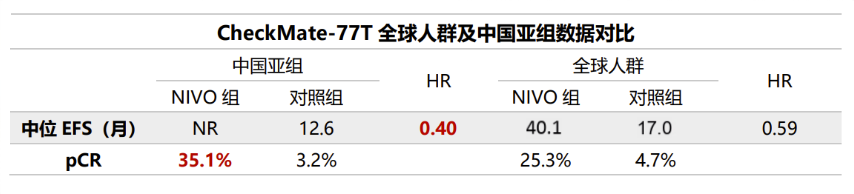
图3:CheckMate 77T全球人群及中国亚组数据对比
围术期模式可能比单纯新辅助治疗更具优势,但需平衡治疗时长和毒性。
3 2025NSCLC围手术期靶向治疗的进展
随着分子靶向治疗的快速发展,针对驱动基因阳性的非小细胞肺癌(NSCLC)围术期靶向治疗取得了显著进展。根据驱动基因类型(如EGFR、ALK等),靶向治疗已从晚期治疗前移至围术期,为特定人群提供了新的治疗选择。
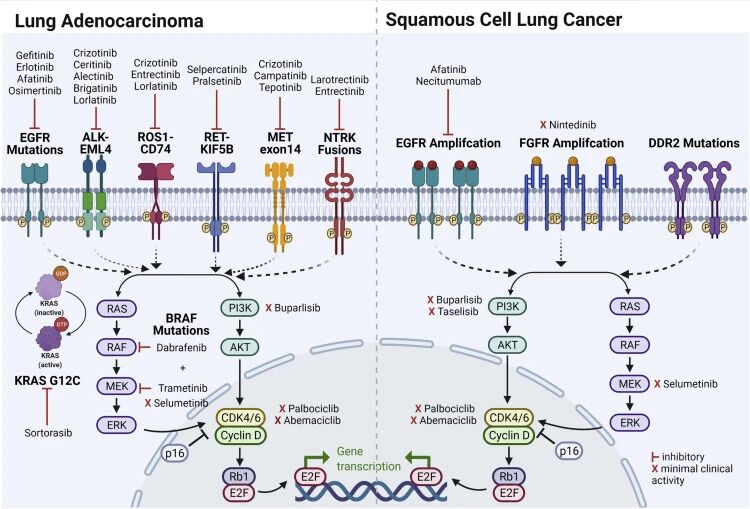
图4:NSCLC常见治疗靶点
3.1 EGFR突变NSCLC围术期靶向治疗
3.1.1 辅助靶向治疗
ADAURA研究:是一项里程碑式的III期研究,评估奥希替尼作为辅助治疗用于完全切除的IB-IIIA期EGFR突变患者。研究显示,奥希替尼显著改善II-IIIA期患者的DFS,疾病复发或死亡风险降低约80%。2023年更新数据显示,奥希替尼组II-IIIA期患者5年OS率达85%,显著高于对照组的73%。该研究确立了奥希替尼作为EGFR突变患者术后辅助标准治疗的地位[11]。目前指南推荐对EGFR 19外显子缺失或21外显子L858R突变的IB-IIIA期患者,在术后接受奥希替尼辅助治疗3年。
3.1.2 新辅助靶向治疗
NeoADAURA研究:评估奥希替尼在新辅助治疗中的价值。与单纯化疗相比,奥希替尼(单药或联合化疗)显著提高MPR率(奥希替尼联合化疗组MPR达26%,单药组25%,化疗组仅为2%)。然而,pCR率相对较低(奥希替尼单药组9%,联合组4%)。12个月EFS率在奥希替尼组和联合组分别为95%和93%,优于化疗组的83%[12]。尽管新辅助靶向治疗的pCR率不如免疫治疗,但初步证明其可改善病理应答,为EGFR突变患者提供了新的术前治疗选择。
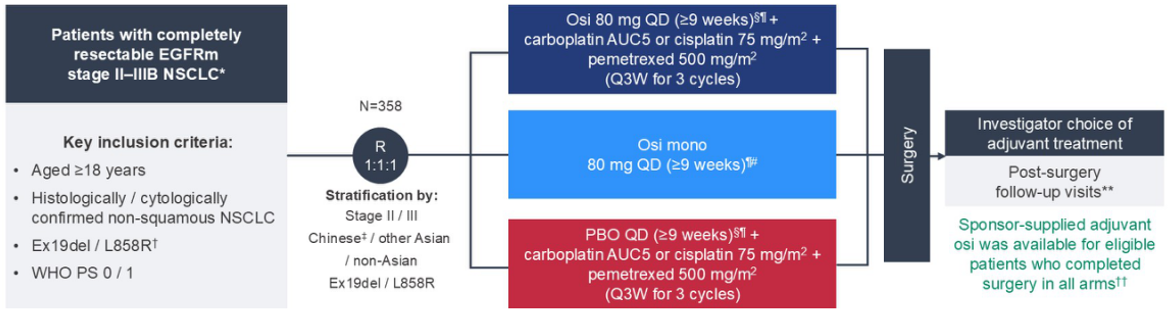
图5:NeoADAURA研究设计
3.2 ALK重排NSCLC围术期靶向治疗
ALINA研究:评估阿来替尼作为辅助治疗用于ALK阳性IB(≥4 cm)-IIIA期患者。结果显示,阿来替尼组2年DFS率达93.8%,化疗组为63.0%;3年DFS率从53.3%提高至88.7%,HR为0.24。阿来替尼在中枢神经系统控制及安全性方面优于化疗。基于此,FDA于2024年批准阿来替尼用于ALK阳性NSCLC术后辅助治疗[13]。目前ALK阳性患者新辅助靶向治疗数据相对欠缺,但相关研究(如ALNEO试验)正在进行中,未来可能实现突破。
3.3 少见靶点突变NSCLC围术期靶向治疗
除EGFR和ALK外,NSCLC还存在KRAS、ROS1、RET、MET、HER2、BRAF等驱动基因。针对这些靶点的围术期研究正在积极开展:
KRAS G12C:MDACC II期研究评估新辅助索托拉西布,主要终点为MPR;Neo-KAN研究评估阿达格拉西布,主要终点为pCR[14]。
RET融合:LIBRETTO-432 III期研究评估塞普替尼辅助治疗,主要终点为EFS。
多靶点探索:NAUTIKA-1 II期研究评估围术期针对ALK、ROS1、NTRK等多靶点的靶向治疗。这些研究有望为罕见驱动基因阳性患者提供新的围术期治疗选择。
3.4 围术期靶向治疗的预后指标
病理缓解评估:pCR和MPR是重要替代终点。在靶向治疗中,MPR率提升显著,但pCR率相对较低(如奥希替尼新辅助治疗pCR率约4-9%)。
ctDNA动态监测:ADAURA研究的探索性分析显示,术后ctDNA清除与预后密切相关。奥希替尼治疗中ctDNA持续阴性患者预后最佳,而ctDNA阳性提示复发风险高。ctDNA有望成为指导靶向治疗决策的重要工具。
4 总结与展望
回顾2025年,NSCLC外科治疗领域的突破主要体现在三个方面:一是手术技术的微创化与精准化程度不断加深;二是围手术期免疫治疗(ICIs)的方案得到优化与拓展;三是围手术期靶向药物的应用探索取得新发现。这些重要进展为2026年实现新的治疗突破开辟了道路,令人对肺癌的长期疾病管理前景充满信心。
参考文献
1. Altorki NK, Wang X, Kozono D, et al. Lobar or Sublobar Resection for Peripheral Stage IA Non-Small-Cell Lung Cancer. N Engl J Med. 2023;388(6):489-498.
2. Chu NQ, Tan KS, Dycoco J, et al. Determinants of successful minimally invasive surgery for resectable non-small cell lung cancer after neoadjuvant therapy. J Thorac Cardiovasc Surg. 2025 Mar;169(3):753-762.e6.
3. Niu Z, Cao Y, Du M, et al. Robotic-assisted versus video-assisted lobectomy for resectable non-small-cell lung cancer: the RVlob randomized controlled trial. EClinicalMedicine. 2024 Jul 12;74:102707.
4. Forde PM, Spicer J, Lu S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med. 2022;386(21):1973-1985.
5. Wakelee H, Liberman M, Kato T, et al. Perioperative Pembrolizumab for Early-Stage Non-Small-Cell Lung Cancer. N Engl J Med. 2023;389(6):491-503.
6. Yue D, Wang W, Liu H, et al. Perioperative Tislelizumab plus Neoadjuvant Chemotherapy for Patients with Resectable Non-Small-Cell Lung Cancer (RATIONALE-315): An Interim Analysis of a Randomised Clinical Trial. Lancet Respir Med. 2025;13(2):119-129.
7. Felip E, Altorki N, Zhou C, et al. Adjuvant Atezolizumab after Adjuvant Chemotherapy in Resected Stage IB–IIIA Non-Small-Cell Lung Cancer (IMpower010): A Randomised, Multicentre, Open-Label, Phase 3 Trial. Lancet. 2021;398(10308):1344-1357.
8. O'Brien M, Paz-Ares L, Marreaud S, et al. Pembrolizumab versus Placebo as Adjuvant Therapy for Completely Resected Stage IB–IIIA Non-Small-Cell Lung Cancer (PEARLS/KEYNOTE-091): An Interim Analysis of a Randomised, Triple-Blind, Phase 3 Trial. Lancet Oncol. 2022;23(10):1274-1286.
9. Heymach JV, Harpole D, Mitsudomi T, et al. Perioperative Durvalumab for Resectable Non-Small-Cell Lung Cancer. N Engl J Med. 2023;389(18):1672-1684.
10. Cascone T, Awad MM, Spicer JD, et al. Perioperative Nivolumab in Resectable Lung Cancer. N Engl J Med. 2024;390(19):1756-1769.
11.Tsuboi M, Herbst RS, John T, et al. Overall Survival with Osimertinib in Resected EGFR-Mutated NSCLC. N Engl J Med. 2023;389(2):137-147.
12. He J, Tsuboi M, Weder W, et al. Neoadjuvant Osimertinib for Resectable EGFR-Mutated Non-Small Cell Lung Cancer. J Clin Oncol. 2025. [Online ahead of print]
13. Wu YL, Dziadziuszko R, Ahn JS, et al. Alectinib in Resected ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2024;390(14):1265-1276.
14. Huang Q, Li Y, Huang Y, et al. Advances in Molecular Pathology and Therapy of Non-Small Cell Lung Cancer. Signal Transduct Target Ther. 2025;10(1):186.
排版:lagertha
审核:胡学飞教授
来源:肿瘤界