在精准医疗日益深入的今天,人工智能(AI)与临床研究的深度融合正推动肿瘤诊疗迈向智能化、个体化的新时代。复旦大学附属肿瘤医院邵志敏教授团队独立构建的乳腺癌“复旦四分型”体系,为HR+/HER2-乳腺癌的精准治疗奠定了关键理论基础。面对CDK4/6抑制剂耐药后缺乏标准治疗方案的临床困境,团队依托乳腺癌精准治疗协作组(BCTOP),设计并主导了名为LINUX(BCTOP-L-M05, NCT05594095)的临床试验。
2025年12月4日,该研究的完整成果正式发表于顶级学术期刊Cancer Cell (IF 44.5)。该研究首次在前瞻性临床层面系统验证了基于“复旦四分型”(SNF分型)的精准治疗策略的有效性,标志着人工智能辅助分型系统成功应用于破解CDK4/6抑制剂耐药难题,为晚期HR+/HER2-乳腺癌的后线治疗提供了高级别循证医学证据,并彰显了平台试验设计在高效探索个体化方案中的巨大潜力。

在乳腺癌这一全球高发癌症中,HR+亚型约占全部病例的三分之二[1]。尽管内分泌治疗的应用显著改善了患者的预后,但该群体在诊断后长达20-30年的时间里,仍持续受到复发和转移的威胁[2]。而CDK4/6抑制剂等靶向药物的问世与普及,为晚期HR+乳腺癌患者带来了生存期的显著突破,推动其疾病管理模式向长期、慢性的方向转变。然而,一旦对CDK4/6抑制剂产生耐药,后续治疗缺乏标准方案,疗效有限且持续时间短,已成为临床实践中的突出难题。这一不断扩大的患者群体,亟需更精准、更有效的治疗策略。
传统分子分型如PAM50依赖于基因表达谱,存在成本高、周期长,且难以全面反映肿瘤异质性的局限。邵志敏教授团队前期通过多组学分析建立了“复旦四分型”[3],包括:经典腔面型(SNF1)、免疫调节型(SNF2)、增殖型(SNF3)和RTK驱动型(SNF4)。团队进一步开发了基于数字病理与深度学习的AI模型,仅通过常规HE染色切片即可实现精准分型,大幅降低了临床转化门槛。
LINUX试验是一项多中心、随机、对照的Ⅱ期平台试验,采用贝叶斯适应性设计。研究共纳入105例CDK4/6抑制剂治疗后进展的HR+/HER2-晚期乳腺癌患者,通过AI模型进行SNF亚型分类后,按1:2比例随机分配至亚型指导的精准治疗组或医师选择治疗(TPC)组(精准治疗组70例,对照组35例)。治疗方案:SNF1亚型接受依维莫司 + 内分泌治疗;SNF2亚型接受卡瑞利珠单抗 + 法米替尼 + TPC;SNF3亚型接受氟唑帕利 + TPC;SNF4亚型接受阿帕替尼 + TPC。TPC组则接受单药化疗(卡培他滨、白蛋白紫杉醇、长春瑞滨或艾立布林)。
研究终点:主要终点为客观缓解率(ORR),次要终点包括临床获益率、无进展生存期、总生存期及安全性。
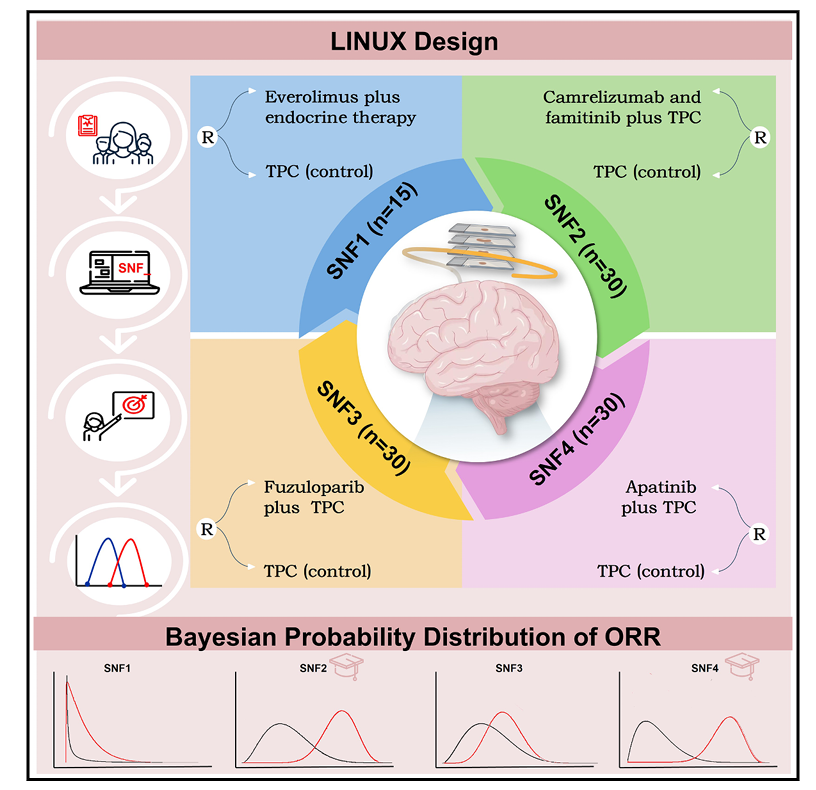
图1.研究设计[4]
中位随访18.3个月,亚型导向的精准治疗在SNF2和SNF4亚型中表现出显著疗效优势。SNF2亚型:精准治疗组ORR达65%,显著高于TPC组的30%;中位PFS延长至8.1个月(TPC组4.3个月)。SNF4亚型:精准治疗组ORR高达70%,TPC组仅为20%;中位PFS为7.0个月(TPC组3.4个月)。SNF1与SNF3亚型:精准治疗未显示显著优势。SNF1亚型因无效提前终止入组(精准组ORR 10% vs TPC组 0%);SNF3亚型未达到成功标准(精准组ORR 40% vs TPC组 30%)。整体人群:精准治疗组ORR为51%,TPC组为23%。
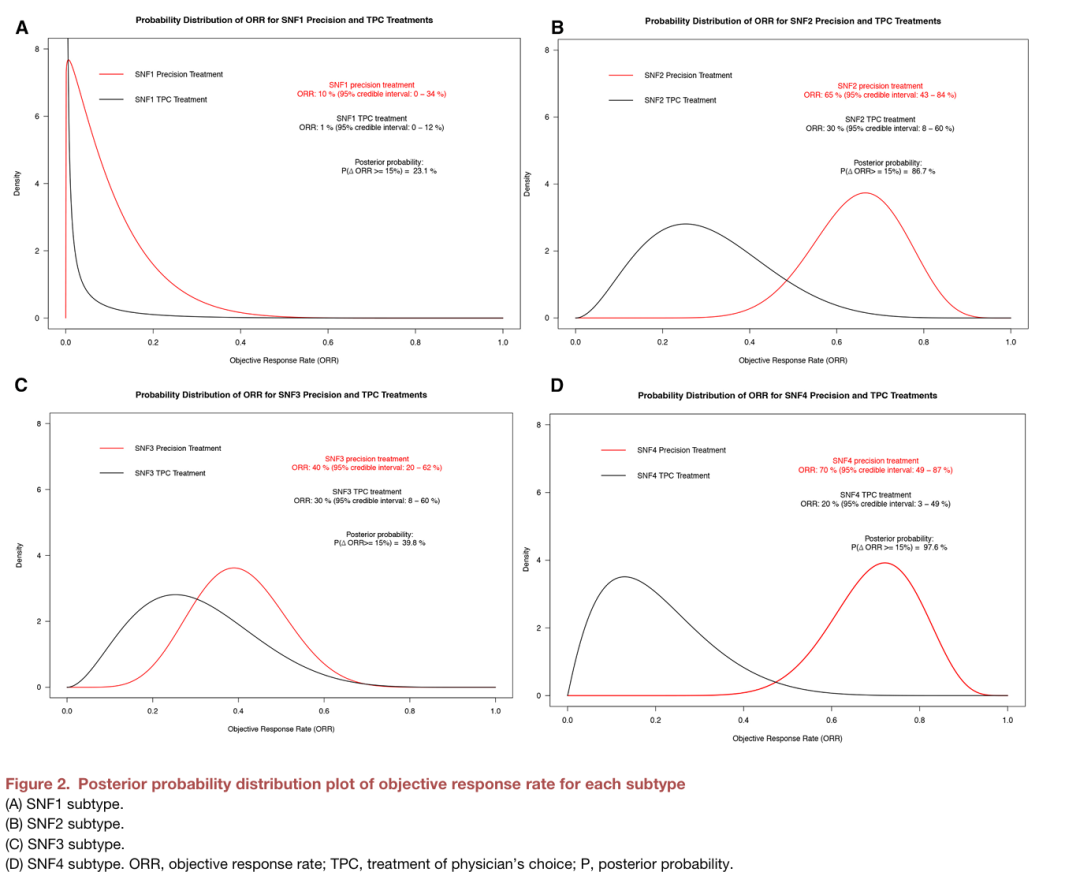
图2 主要终点ORR[4]
两组安全性总体可控。所有患者均发生至少1例任意级别治疗相关不良事件(TRAE)。≥3级TRAE发生率在两组中相同(均为37%)。最常见的≥3级TRAE为中性粒细胞计数减少和白细胞减少。各亚型精准治疗方案的特异性≥3级TRAE均与药物已知毒性谱相符。
LINUX试验表明,基于AI病理分型指导的精准治疗策略,在CDK4/6抑制剂耐药的HR+/HER2-晚期乳腺癌患者中具有明确的临床价值。该策略成功筛选出了对特定联合方案高度敏感的SNF2和SNF4患者群体,使其ORR和PFS得到显著改善。这为乳腺癌的精准分型治疗提供了前瞻性临床证据,并验证了将人工智能工具整合到常规临床决策流程中的可行性。
随着CDK4/6抑制剂成为HR+/HER2-晚期乳腺癌的标准治疗,其耐药后缺乏有效方案已成为临床紧迫难题。LINUX研究正是针对这一困境展开,首次前瞻性证实了SNF分型指导精准治疗的可行性与优效性,成功构建了“临床问题—分子分型—靶向干预—疗效验证”的完整科研闭环。
研究结果显示,在SNF2与SNF4患者中,基于分型的精准治疗相比传统化疗显著提升疗效:SNF2亚型ORR达65%,SNF4亚型ORR达70%,中位无进展生存期PFS也实现翻倍延长。这标志着借助分子分型实现“同病异治”的策略,在高级别循证证据支持下得以落地,为CDK4/6i耐药患者提供了明确的治疗新方向。
LINUX研究的深远影响,远超其对特定临床问题的解答。其在国际上首次创新性设计并完成了由人工智能(AI)全程驱动的临床试验,这一突破性实践标志着精准医疗“第二次革命”的开启。
第一次精准医疗革命依赖于基因测序等分子技术,实现了对特定驱动靶点的静态识别,但存在成本高、靶点覆盖有限的瓶颈。LINUX研究引领的第二次革命,实现了三大根本性变革:一是决策模式革命。研究实现了从“靶点指导”到“模型驱动”的跨越。通过AI模型直接解读常规HE病理切片,整合海量形态与微环境信息,输出可直接指导治疗的分型结果,将精准诊疗的门槛和成本降至极低。二是研究范式革命。采用基于贝叶斯假设的平台试验设计,从传统的“假设验证”转向“主动发现”,能依据实时数据动态优化治疗方案分配,极大提升了研发与验证效率。三是应用场景革命。该模式摆脱了对中心实验室的依赖。理论上,具备数字病理设备的医疗机构即可接入AI平台,使前沿精准方案有望快速普惠至基层。
综上所述,LINUX研究不仅验证了SNF分型的临床价值,更通过将AI置于临床决策核心,推动了研究范式的根本性变革。随着后续III期验证及治疗骨架向ADC等升级,这种AI驱动的平台试验模式,正引领肿瘤治疗从“普适治疗”迈向“智慧精准”的新纪元,为全球抗癌事业开辟出一条更具可及性、智能化的全新道路。
参考文献
1.Sung H, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.CA Cancer J Clin. 2021;71(3):209-249.
2.Pan H, et al. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years.N Engl J Med. 2017;377(19):1836-1846.
3.Jin et al. Molecular classification of hormone receptor-positive HER2-negative breast cancer. Nature Genetics. 2023;55(10):1643–1656.
4.Fan et al. Precision treatment with artificial intelligence assisted subtyping enhances therapeutic efficacy in HR+/HER2– breast cancer: The LINUX trial. Cancer Cell. 2026;44:1-11.
推荐阅读
来源:医脉通