预免疫细胞治疗实体瘤:聚焦双特异性抗体武装T/NK细胞
Immune cell therapy for solid tumors: focus on bispecific antibody armed T/NK cells
肿瘤免疫治疗进入“活细胞药物”时代,CAR-T、TIL、CIML NK等过继性细胞疗法相继取得突破,尤其为血液肿瘤患者带来治愈希望。然而,这些明星疗法在走向实体瘤和大规模临床应用的道路上,仍面临成本高昂、制备复杂、靶点局限、安全性风险等多重壁垒。如何突破瓶颈,让更多患者用得上、用得起、用得好?
近期,一种“无需基因编辑、即用型、可模块化切换”的新型细胞治疗策略——双特异性抗体武装的T/NK细胞疗法,正从实验室快速走向临床,为实体瘤治疗提供了全新思路。
南京大学医学院附属鼓楼医院肿瘤医学中心主任刘宝瑞教授团队在《中国肿瘤生物治疗杂志》最新发表的述评中,为您系统梳理这一新兴技术的三大核心优势与突破方向:

南京大学
刘宝瑞 博士,教授、主任医师,博士生导师,曾在美国MD Anderson Cancer Center从事博士后研究。现任南京大学医学院附属鼓楼医院肿瘤医学中心主任、免疫治疗中心主任,南京大学临床肿瘤学研究所所长,兼任中国临床肿瘤学会胃癌专家委员会副主任委员、江苏省抗癌协会整合肿瘤分会主任委员、中国抗癌协会整合肿瘤学分会前任主任委员、江苏省医师协会肿瘤化疗与生物治疗医师分会会长。享受国务院政府特殊津贴专家,中国医师奖获得者、江苏省突出贡献专家。主要从事难治性肿瘤的个体化药物治疗及靶向免疫治疗。以第一作者或通信作者身份在J Nat Cancer Inst、J Clin Invest、J Clin Oncol、Nat Commun、Adv Funct Mater、Biomaterials等学术期刊发表SCI论文200余篇。主持国家重点研发计划重点专项、国家自然科学基金(含国际合作研究重大项目和重点项目各1项)等多项研究课题,先后获江苏省科学技术一等奖等40项科技成果奖,获国家发明专利授权16项,主编Personalized Management of Gastric Cancer等学术专著5部。
过继细胞疗法在肿瘤免疫治疗领域持续革新,其中双特异性抗体武装T细胞/自然杀伤细胞(T/NK细胞)技术通过抗体靶向并桥接免疫细胞,赋予其精准靶向杀伤能力的同时突破传统技术局限,兼具制备标准化程度高、安全性可控及临床转化周期短等核心优势,在实体瘤及血液系统恶性肿瘤治疗中均呈现出突破性临床潜力。本文系统评述嵌合抗原受体基因修饰T淋巴细胞/自然杀伤细胞(CAR-T/NK细胞)、肿瘤浸润淋巴细胞(TIL)和细胞因子诱导的记忆样NK细胞(CIML NK细胞)疗法的研究进展,并重点探讨双特异性抗体武装T/NK细胞技术的作用机制、优势、临床进展及前沿趋势。

近年来,嵌合抗原受体基因修饰T淋巴细胞(CAR-T细胞)/NK细胞(CAR-NK细胞)(统称CAR-T/NK细胞)、肿瘤浸润淋巴细胞(TIL)与细胞因子诱导的记忆样NK细胞(cytokine-induced memory-like natural killer cell, CIML NK细胞)三大过继性细胞疗法在肿瘤免疫治疗领域取得了突破性进展,但仍面临若干关键挑战。CAR-T/NK细胞技术通过基因工程赋予细胞精准靶向能力,在血液肿瘤治疗中成效显著,然而,其广泛应用仍受到治疗成本高昂、病毒载体潜在安全性风险以及靶点切换受限等因素的制约;TIL疗法依赖多克隆T细胞的识别能力以应对肿瘤异质性,虽在实体瘤中首获商业化突破,然而,由于组织获取的局限性及制备过程的复杂性,其推广应用仍面临较大挑战;CIML NK细胞疗法通过细胞因子诱导NK细胞产生记忆样功能,从而显著增强其抗肿瘤免疫应答能力,但由于其缺乏天然的靶向特异性,限制了该疗法在临床上的广泛应用。以下将详细阐述各疗法的最新研究进展及其临床应用的局限性。
1.1 CAR-T/NK进展与临床局限性
基因工程改造的CAR-T/NK细胞是指利用基因工程技术将抗原识别结构域与T/NK细胞激活结构域相结合,赋予免疫细胞特异性识别并杀伤靶细胞的能力。该技术的核心优势在于突破主要组织相容性复合体限制性,实现靶向抗原的直接识别,从而显著提高免疫治疗的精准性。在CAR-T细胞领域,截至2025年5月,美国食品药品监督管理局(FDA)已批准6款CAR-T细胞治疗产品上市,适应证主要集中于复发/难治性B细胞淋巴瘤和多发性骨髓瘤等血液系统肿瘤。值得注意的是,现阶段尚未有靶向实体瘤的CAR-T细胞产品获批临床应用,但基于间皮素(mesothelin, MSLN)、紧密连接蛋白18.2(claudin18.2, CLDN18.2)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)、前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA)等新型靶点的临床试验已在胃癌、卵巢癌、神经胶质瘤和肾癌等多种实体瘤中展开,相关研究正积极探索其临床转化潜力。相较于CAR-T细胞疗法,CAR-NK细胞疗法具有三大核心优势:首先,固有免疫特性赋予非抗原依赖性广谱杀伤能力;其次,细胞因子释放综合征(CRS)相关细胞因子(如白细胞介素6)分泌水平低,治疗相关不良反应显著减少;第三,同种异体输注安全性高且具有肿瘤微环境浸润优势,尤其在实体瘤治疗中展现应用潜力。现阶段已有多项CAR-NK细胞疗法进入临床试验阶段,相关研究结果尚未公布。
尽管CAR-T/NK细胞技术取得显著成果,其临床应用仍受制于以下瓶颈:(1)成本与技术壁垒。目前,所有市售CAR-T细胞均采用基于病毒载体的转基因递送技术,而慢病毒/逆转录病毒载体的GMP级生产工艺复杂、质控严格,加之需针对个体患者单独制备载体,并叠加细胞冻存与冷链运输等环节,导致单批次治疗成本高达4万至6万美元。上述生物制造体系的技术复杂性与经济不可及性,严重制约了该疗法的临床推广。(2)安全性问题。该技术体系存在双重生物安全风险,其一,病毒载体介导的转基因存在基因组随机整合倾向,可能因插入位点邻近原癌基因而触发潜在致癌风险;其二,病毒载体在生产过程中可能发生载体重组事件,存在产生具备复制能力的逆转录病毒或慢病毒的隐患,其长期安全性仍需持续监测。(3)靶点切换困难,灵活性差。当前CAR-T/NK细胞治疗存在靶点切换灵活性不足的技术瓶颈。由于CAR分子结构的固有特性,其靶向抗原特异性在工程化改造时即被固定,临床应用中无法实现动态调控。例如,在治疗血液肿瘤时,当肿瘤细胞发生CD19抗原逃逸转而高表达CD22时,必须通过复杂的载体重构流程重新设计CAR结构。这些局限性凸显了开发新型非基因编辑依赖性肿瘤靶向策略的必要性。
1.2 TIL疗法进展与局限性
TIL疗法通过从患者自体肿瘤组织中分离并富集淋巴细胞,体外经细胞因子激活扩增后,将大量增殖的效应细胞回输至患者体内以发挥抗肿瘤作用。与其他细胞疗法相比,TIL主要由多种携带独特T细胞受体克隆的T细胞亚群组成,所以能够识别广泛的肿瘤新抗原表位,因此在解决肿瘤异质性方面具有优势。此外,TIL中以效应记忆T细胞为主,这类细胞表面表达归巢受体,具备卓越的肿瘤归巢能力。同时,TIL在发育过程中经历了胸腺阴性选择,因此表现出对正常组织的低毒性。凭借其卓越的肿瘤定位能力、归巢能力和安全性特征,TIL疗法在实体瘤治疗领域展现出巨大的临床应用潜力。目前,已在黑色素瘤、宫颈癌、非小细胞肺癌等癌种中开展多项临床试验并取得突破性进展。2024年2月,美国FDA加速批准lifileucel上市,该产品不仅是全球首个获批用于治疗不可切除/转移性黑色素瘤的TIL疗法,更开创了实体瘤领域过继细胞治疗商业化应用的先河。
TIL疗法虽展现显著潜力,但其临床转化仍面临多重技术壁垒:其一,肿瘤活检样本获取困难,特别是在特定实体瘤类型中,导致大量患者不符合治疗准入标准;其二,术后可分离扩增的TIL亚群比例有限,并非所有实体瘤中均存在具有抗肿瘤活性的效应T细胞;其三,细胞制备过程涉及复杂的体外活化扩增步骤,需要齐全的设备及充足的专业技术知识,这也导致了高成本和长制备时间;针对上述局限性,基于双特异性抗体的工程化改造策略为技术升级提供新方向。双特异性抗体武装的T/NK细胞技术可突破传统TIL疗法对肿瘤原位取材的依赖,同时增强效应细胞对低抗原密度肿瘤的识别能力。这种模块化工程改造策略,为构建“即用型”的实体瘤免疫治疗方案提供了新思路。
1.3 CIML NK细胞疗法进展与局限性
通过细胞因子预刺激形成持久记忆的CIML NK细胞疗法是一种通过多重细胞因子协同刺激实现NK细胞功能重塑的过继免疫治疗技术。相较于未处理的NK细胞,CIML NK细胞在活化过程中关键生物学改变表现为CD25(白细胞介素2受体α链)表达显著上调,促进形成高亲和力白细胞介素2受体复合体,从而增强细胞对白细胞介素2信号的应答能力。这种功能重构最终体现为效应细胞的增殖效率提升与γ干扰素分泌量增加,进而强化其靶向清除肿瘤细胞的治疗效力。现阶段全球范围内已启动多项CIML NK细胞疗法临床试验,主要针对血液系统肿瘤。
CIML NK细胞因其显著提升的抗肿瘤活性、增强的体内扩增能力及长效体内存活能力等特性在过继性细胞治疗领域展现出重要应用价值。然而,其本质性缺陷在于肿瘤靶向特异性缺失,这严重制约了其临床转化潜力。当前技术优化主要沿两大路径推进:其一是构建CAR-CIML NK细胞复合细胞平台,其二是采用双特异性抗体对CIML NK细胞实施功能性修饰。相较前者涉及的复杂基因编辑流程,双特异性抗体修饰策略既规避了CAR结构引入的工艺挑战,又能完整维系CIML NK细胞的天然抗肿瘤特性,同时赋予其精准靶向能力。
双特异性抗体武装的T/NK细胞疗法是一种新型免疫细胞治疗策略,其核心原理在于利用双特异性抗体的双向结合特性,同时靶向免疫细胞表面的活化受体(如T细胞的CD3或NK细胞的CD16a)和肿瘤特异性抗原(tumor-specific antigen, TSA)。通过体外共孵育技术,将双特异性抗体稳定修饰于T/NK细胞膜表面,从而在不依赖基因编辑的前提下,赋予效应细胞特异性的肿瘤靶向与杀伤能力(图1)。
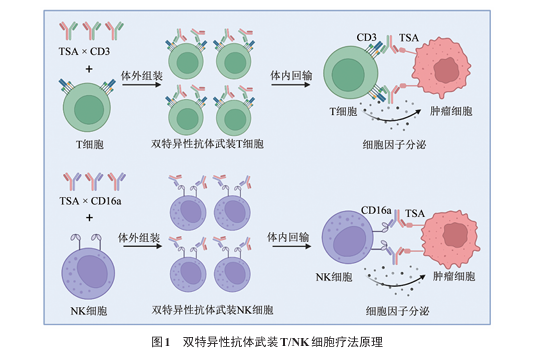
相较于CAR-T/NK细胞疗法,该策略无需病毒载体转导或基因组编辑,从而完全规避插入突变风险,同时其制备周期短,成本低。值得注意的是,临床前研究显示,在神经母细胞瘤小鼠模型中,双特异性抗体武装的T细胞较同剂量CAR-T细胞治疗组呈现出两大显著优势:其一为肿瘤体积缩小速率提升,其二为肿瘤微环境内效应免疫细胞浸润密度增加,提示其具有更强的肿瘤清除能力和免疫微环境重塑潜力。相较于TIL疗法,双特异性抗体武装策略突破了自体肿瘤样本采集的限制,且可依托预制备的通用型抗体库实现标准化即用型治疗模式。此外,相较于CIML NK细胞技术,双特异性抗体武装策略在保留CIML NK细胞固有细胞毒性功能及扩增能力的基础上,通过双特异性靶向结构赋予其精准的肿瘤归巢能力,提升其治疗效果。
3.1 临床前研究
在神经胶质瘤模型中,表皮生长因子受体(EGFR) × CD3和HER2 × CD3双靶向T细胞联合应用可有效清除替莫唑胺耐药及CD133阳性的肿瘤干细胞亚群,从而有效发挥肿瘤杀伤作用。黑色素瘤模型研究表明,HER2特异性修饰T细胞能够精准识别肿瘤细胞,其荷瘤动物模型的完全缓解率与CD69激活标志物表达水平呈显著正相关,输注修饰后的T细胞成功抑制了黑色素瘤的生长。结直肠癌治疗策略中,EGFR双特异性抗体武装的T细胞与肿瘤坏死因子超家族成员14(tumor necrosis factor superfamily member 14, TNFSF14)协同作用能够有效重塑肿瘤免疫微环境,具体表现为肿瘤浸润淋巴细胞密度增加和抗肿瘤疗效提升。针对胆管癌开发的整合素αvβ6靶向双特异性抗体修饰T细胞方案在三维培养模型中展现出持续杀伤特性,其机制涉及效应记忆T细胞亚群扩增与穿孔素/颗粒酶分泌通路激活。骨肉瘤中的研究显示,双唾液酸神经节苷脂GD2(disialoganglioside GD2, GD2)和HER2双靶点序贯疗法联合程序性死亡配体1(programmed death-ligand 1, PD-L1)阻断可产生协同效应,显著改善荷瘤模型生存结局。在前列腺癌治疗研究中,CD155 × CD3、前列腺六次跨膜上皮抗原1(six-transmembrane epithelial antigen of prostate 1, STEAP1) × CD3等双抗武装T细胞疗法在体外均呈现剂量依赖性杀伤特征,小鼠模型实验进一步验证了其抗肿瘤效能。膀胱癌研究证实,CD155、EGFR、HER2三靶点高表达特性,针对各靶点独立构建的双特异性T细胞疗法在临床前模型中均显示出明确治疗价值。在乳腺癌模型中,CD3 × HER2双抗修饰T细胞在HER2阳性的乳腺癌细胞中也呈现出剂量依赖性毒性。值得注意的是,PD-L1 × CD3双特异性抗体修饰T细胞在乳腺癌模型中表现出双重作用机制,即直接细胞毒效应与PD-1/PD-L1信号轴阻断的协同作用[36],这也证实了PD-L1 × CD3双特异性抗体修饰T细胞在治疗PD-L1阳性表达肿瘤方面的潜力。上述临床前研究明确验证了双特异性抗体武装的活化T细胞对多种肿瘤靶点的高效靶向和杀伤活性。
3.2 临床研究
双特异性抗体武装T细胞在多种恶性肿瘤的临床研究中取得阶段性成果。下面基于现有Ⅰ/Ⅱ期试验数据,从不同实体瘤的应用效果、安全性及免疫反应等方面综述其进展。在乳腺癌中,HER2靶向研究呈现差异化成果:在HER2阳性患者中进行的Ⅰ期试验(n = 23)显示,双特异性抗体武装T细胞联合白细胞介素2和粒细胞-巨噬细胞集落刺激因子治疗后,HER2阳性患者中位总生存期达57.4个月,显著优于低表达组(27.4个月,P = 0.036),且Th1细胞因子水平显著升高;而在HER2阴性患者中进行的Ⅱ期研究(n = 32)表明,化疗后使用该疗法进行免疫巩固可使56.5%患者肿瘤标志物下降,三阴性亚组中位总生存期延长至12.3个月。在神经胶质瘤领域,EGFR靶向的I期试验(n = 7)证实,双特异性抗体修饰T细胞联合放化疗方案安全性可控(最高剂量8 × 1010个细胞/次),治疗后患者外周血单核细胞特异性细胞毒性及NK活性显著增强(P < 0.03),中位总生存期达28.8个月。胰腺癌Ⅰ/Ⅱ期研究(n = 7)中位总生存期为31个月,其中2例患者化疗后达到完全缓解。前列腺癌研究中,联合帕博利珠单抗方案使14例转移性去势抵抗性前列腺癌患者中位生存期达31.6个月,38.5%患者在6个月时无进展。儿童神经母细胞瘤/骨肉瘤的Ⅰ/Ⅱ期试验突破性采用GD2靶点,Ⅱ期患者中位总生存期达31.2个月,且1.6 × 108个细胞/kg剂量下仅出现可控的1~3级CRS。
现有研究一致表明,双特异性抗体武装T细胞治疗未出现4级以上不良反应,主要不良反应为短期发热、寒战等症状,且在输注后普遍诱导特异性T细胞毒性增强及Th1型细胞因子升高。然而,当前试验普遍存在样本量小(n = 7~32)、随访时间有限等问题,临床疗效评估仍需扩大样本验证。未来研究可进一步探索双特异性抗体武装T细胞治疗与免疫检查点抑制剂、靶向治疗的联合策略,以优化抗肿瘤免疫微环境。
4.1 临床前研究
相较于T细胞,NK细胞因其无需抗原预致敏、快速杀伤能力及低移植物抗宿主病风险等独特优势,逐渐成为肿瘤免疫治疗领域的重要研究方向。研究表明,四价双特异性抗体AFM13(靶向CD30/CD16A)联合CIML NK细胞可显著增强抗淋巴瘤效应。其作用机制涉及AFM13介导的免疫突触形成,通过同时桥接肿瘤细胞表面CD30与NK细胞CD16A受体,激活NK细胞脱颗粒反应并促进γ干扰素、肿瘤坏死因子等效应因子分泌。分子机制研究进一步揭示,该策略可显著上调C-C基序趋化因子配体(C-C motif chemokine ligand, CCL)等炎症通路相关基因的转录水平,诱导NK细胞效应表型强化。在CD30阳性淋巴瘤小鼠模型中,AFM13武装的NK细胞展现出持续抑制肿瘤生长的能力,使荷瘤小鼠生存期显著延长(P < 0.05)。这些发现揭示了双特异性抗体武装细胞因子诱导记忆性NK细胞在抗肿瘤治疗中巨大潜力,为未来临床转化提供了重要依据。
4.2 临床研究
基于上述临床前研究证据,双特异性抗体武装NK细胞复合疗法的临床试验取得突破性进展。一项发表于Nat Med的Ⅰ期研究纳入44例经中位7线治疗的CD30阳性淋巴瘤患者(含37例霍奇金淋巴瘤),采用淋巴清除序贯AFM13修饰NK细胞输注(106~108个细胞/kg)联合AFM13强化治疗。结果显示,总体缓解率达92.9%,完全缓解率为66.7%,其中霍奇金淋巴瘤亚组完全缓解率提升至73%。在中位20个月随访期内,2年总生存率达76.2%,11例患者实现14~40个月的持续缓解。安全性分析显示,未发生CRS或移植物抗宿主病,主要不良反应为可控性骨髓抑制(76.2%出现中性粒细胞减少)及感染并发症。研究证实,经IL-12/15/18预激活的脐带血NK细胞负载AFM13后,CD16结合效率超过90%,并能定向迁移至肿瘤部位维持活化状态至少3周,这项研究初步验证了“即用型”异体NK细胞疗法的可行性,但受限于Ⅰ期研究样本量及NK细胞体内存续时间等问题,其长期疗效及广泛适用性仍需更大规模研究验证。目前暂无针对实体瘤的研究进入临床试验。
过继性细胞治疗技术正推动肿瘤治疗模式变革。本文重点阐述了CAR-T/NK疗法、TIL疗法、CIML NK疗法在临床推进过程中所面临的问题,同时梳理了双特异性抗体武装T/NK细胞的优势与思路,旨在为突破实体瘤细胞治疗的瓶颈提供新的视角与理论支持。现有临床前和临床研究数据均表明,该技术在血液肿瘤和实体瘤治疗中均表现出显著疗效,且具有良好的安全性,显示出较强的临床转化潜力。然而,其应用仍面临以下关键瓶颈亟待突破:(1)实体瘤组织穿透效率较低,易受到肿瘤免疫抑制微环境的影响;(2)效应细胞在体内的持久性有限;(3)效应细胞功能易快速耗竭。未来研究可重点关注以下方向:(1)开发新型联合治疗策略,探索其与免疫检查点抑制剂、小分子靶向药物及肿瘤微环境重塑剂之间的协同机制;(2)构建增强肿瘤组织穿透能力的系统,例如在双特异性抗体中引入穿透性分子或肿瘤血管靶向分子;(3)增强效应细胞的干性维持能力,例如在抗体结构中融合细胞因子(如白细胞介素15)等模块。上述技术突破有望推动该治疗体系的进一步发展,拓展其临床应用范围,具有重要的研究价值。
陈天然,刘宝瑞, et al. 免疫细胞治疗实体瘤:聚焦双特异性抗体武装T/NK细胞[J].中国肿瘤生物治疗杂志, 2025, 32(9): 899-905. DOI:10.3872/j. issn.1007-385X.2025.09.001.
图文:苏 念
一审:黄静怡
二审:于益芝
三审:曹雪涛

来源:中国肿瘤生物治疗杂志