编者按: 随着人口老龄化加剧,肿瘤患者的共病(多病共存)患病率每年以0.54%的速度递增,为临床诊疗带来严峻挑战。鉴于此,中国临床肿瘤学会(CSCO)肿瘤支持与康复治疗专家委员会组织多学科专家,制定了《中国肿瘤共病防治专家共识(2025版)》。本共识针对29个核心临床问题,旨在为一线临床医生提供科学、规范、可操作的肿瘤共病全程管理方案。发布机构:中国临床肿瘤学会(CSCO)肿瘤支持与康复治疗专家委员会潘宏铭,香港大学深圳医院肿瘤科,E-mail: panhongming@zju.edu.cn王杰军,蚌埠医科大学第一附属医院,E-mail: wang_jiejun0@163.com罗素霞,河南省肿瘤医院,E-mail: luosxrm@163.com秦叔逵,中国药科大学附属天印山医院,E-mail: qinsk@csco.org.cn引用本文:中国临床肿瘤学会(CSCO)肿瘤支持与康复治疗专家委员会. 中国肿瘤共病防治专家共识(2025版)[J]. 肿瘤防治研究, 2025, 52(11): 879-912. DOI: 10.3971/j.issn.1000-8578.2025.25.0771 |
【摘要】人口老龄化背景下,肿瘤患者的共病患病率每年以0.54%的速度递增,为恶性肿瘤的临床诊治工作带来日益严峻的挑战。目前,我国各地区的各级医院专科医生对于肿瘤共病的认知状况参差不齐,缺乏可操作性强的恶性肿瘤共病管理流程。鉴于此,中国临床肿瘤学会肿瘤支持与康复治疗专委会组织相关领域专家,面向从事恶性肿瘤诊疗工作的一线临床医生,针对29个肿瘤共病管理核心问题,编制了《中国肿瘤共病防治专家共识(2025 版)》,指导科学规范地进行肿瘤共病全程管理。
【关键词】 肿瘤共病;评估;多学科协作;专家共识
实践指南注册: 国际实践指南注册与透明化平台(PREPARE-2025CN1397)
随着人口老龄化加剧,肿瘤患者的共病患病率每年以0.54%的速度递增[1]。共病可导致老年人更高的失能与死亡风险,更多的医疗保健支出和资源利用需求,这些困境也将在临床工作中日益凸显。共病对肿瘤患者的影响贯穿肿瘤诊疗的全过程:共病患者可能因相似症状延迟诊断;可能因治疗引起的不良反应、并发症等风险顾虑,无法接受标准治疗;抗肿瘤治疗不良反应与基础共病的叠加将给预后造成更多的不确定性;共病管理涉及多个专科,检查费用、治疗费用均相应增加。然而,“肿瘤共病临床认知与实践调研”结果显示,我国各地区的各级医院肿瘤专科医生对于肿瘤共病的认知状况参差不齐,缺乏系统、完善、可操作性强的恶性肿瘤共病管理流程。因此,结合国内外文献报道与临床实践经验,中国临床肿瘤学会(CSCO)肿瘤支持与康复治疗专委会编制了《中国肿瘤共病防治专家共识(2025版)》,旨在为一线临床医务工作者提供科学规范、切实可行的肿瘤共病全程管理方案。 2025年4月,由CSCO肿瘤支持与康复治疗专委会组织,来自13个不同直辖市和省份的27名专家组成共识制定工作组,成员专业涉及肿瘤内科、肿瘤外科等相关诊疗领域。本共识已在国际实践指南注册与透明化平台(International Practice Guidelines Registry Platform,http://www.guidelines registry.org)完成注册,注册号:PREPARE-2025CN1397。工作组成员均在无利益冲突前提下参与推荐意见的生成。 本专家共识制订步骤主要包括文献调研、专家会议讨论、临床问题制订、德尔菲法(Delphi法)以及共识修订等。工作组根据系统文献检索和临床专家经验,确定了29个临床问题及其推荐意见,经过专家讨论和投票,对共识相关问题达成不同等级的专家推荐强度。投票设置“完全同意” “基本同意” “中立” “较反对” “完全反对”5个选项,专家共识度(即选择“完全同意”或“基本同意“的专家人数比例)≥80%定义为达成共识。推荐等级根据专家投票分为强推荐和弱推荐两个级别:若“完全同意”的票数占比≥80%,则为强推荐;若“完全同意”的票数占比未达到80%,但“完全同意”与“基本同意”的总票数占比≥80%(即达到共识标准),则为弱推荐。因2025年版共病管理共识的主要形成于专家推荐意见,故不进行证据级别评价。 本共识以建库以来至2025年7月31日为检索时限,在中国知网(CNKI)、万方数据库、Web of Science、Embase、PubMed等检索平台及数据库,针对“恶性肿瘤” “共病”及其与29个临床问题相关的中英文关键词进行广泛检索与回顾,作为专家共识撰写依据。检索结果排除了非中英文、学位论文、索引目录、无法获取全文的文献及重复发表的文献。 本专家共识的使用者为从事恶性肿瘤诊疗相关的肿瘤内科、肿瘤外科、放射治疗科等一线临床医生。目标人群为恶性肿瘤患者。 本共识将通过学术期刊公开发表,利用学术会议、新媒体和推文等多种途径进行宣讲、传播,促进本共识的推广。本共识计划每2年更新1次,以纳入最新的循证医学证据。 第二部分 共识
1 肿瘤共病现状
1.1 肿瘤共病(Oncology multimorbidity)定义根据世界卫生组织(WHO)的定义,共病(Multimorbidity)指的是一个患者同时患有两种或两种以上的慢性非传染性疾病[2]。临床上对于共病诊疗的重点是“以患者为中心”,关注患者的健康结局[3]。复合疾病(Comorbidity) 是指个体虽然拥有两种或两种以上疾病,但是其中存在一种指引性疾病,临床关注重点为指引性疾病的结局。共病的范围中包含了复合疾病。 肿瘤共病广义上指肿瘤患者群体中所面对的“多病共存”的状态,即患者同时存在≥2种疾病,通常表现为多病因疾病。狭义上,肿瘤共病指的是:(1)独立于恶性肿瘤本身,对肿瘤诊治和预后产生影响的一种或多种复合疾病;(2)肿瘤继发性并发症(Complication);(3)抗肿瘤治疗引起的不良反应。 在以往的概念中,共病多强调“共因”,即具有相同/相近病因的一簇疾病的共存状态,而多病共存仅强调“共存”。但专家组认为肿瘤共病的概念不应单纯强调“共因”或“共存”,提倡在厘清肿瘤共病的概念界线的前提下,综合认知并管理对肿瘤诊治全流程产生影响的肿瘤并发症或基础合并症。因此,明确肿瘤共病的定义对于规范管理诊疗流程、形成以实践为本的肿瘤共病体系具有重要意义。
专家共识1:根据世界卫生组织的相关意见和我国临床实践现状及需求,本专家组将肿瘤共病定义为:与恶性肿瘤并存、对肿瘤诊治和预后产生影响的一种或多种并发症或其他疾病状态。 国内共病研究起步相对较晚,研究多以描述性研究为主,单中心、小样本多见,肿瘤共病研究集中于常见肿瘤和常见共病,目前尚缺乏覆盖全国的肿瘤共病发病数据。部分地区或单中心回顾性数据反映出我国肿瘤患者的共病负担较重。例如,北京大学肿瘤医院分别调查了参加城镇职工医疗保险和城市居民医疗保险、HIS系统中的8655例和5338例肺癌患者的共病流行率。结果显示,分别有31.3%、52.8%的患者至少有一种共病[4]。我国学者常峰在对共病概念体系梳理后提出了按照疾病类型的三分类方法:即躯体疾病与躯体疾病共病、精神心理疾病与精神心理疾病共病、以及躯体疾病与精神心理疾病共病[5]。在实际临床实践中,肿瘤共病除了需考虑包括心血管、呼吸、消化代谢、泌尿等多个系统的基础疾病对抗肿瘤治疗的影响,还需要按照疾病对抗肿瘤治疗的干扰程度制定治疗随访计划。
临床问题2:肿瘤共病的临床干预等级分类
专家共识2:按照系统-器官的疾病分类,结合该疾病对抗肿瘤治疗的影响程度与所需干预的紧迫性,分为一级(必须优先稳定或调整方案)、二级(需个体化评估并密切监测)、三级(暂不影响抗肿瘤治疗,但需长期管理),通过共识制定专家组投票产生分级结果,常见肿瘤共病的临床干预等级分类,见表1。 推荐强度:弱推荐;专家共识度:75.0%。
| |
| | |
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
| |
|
|
|
|
|
|
| |
|
| |
|
|
| |
|
|
|
| |
|
|
|
|
|
|
| |
|
| |
|
|
|
| |
|
|
| |
|
|
|
|
|
| |
|
|
|
| |
|
| |
|
|
|
|
|
|
|
| |
|
| |
|
|
|
|
|
|
| |
|
|
|
| |
|
| |
|
|
| |
|
|
| 慢性肝病Child-Pugh A级或MELD F0-F2 |
|
| |
| 慢性肝病Child-Pugh B级或MELD F2 |
| |
|
| 慢性肝病Child-Pugh C级或MELD F3-F4 | |
|
|
|
|
|
|
| |
|
|
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
|
| |
|
| |
|
|
|
|
|
| |
|
|
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
|
|
|
|
| |
|
| |
|
|
|
| |
|
|
| |
|
|
| |
|
| |
|
|
|
|
|
|
|
| |
|
|
| |
|
|
| |
|
|
| |
|
| |
|
|
|
|
|
|
|
| |
|
|
| |
|
| |
|
|
|
| |
|
2 肿瘤共病对内科抗肿瘤治疗的影响
研究表明,共病会显著影响抗肿瘤治疗的决策过程、疗效、不良反应和患者预后[6-9]。此外,共病(包括躯体和精神共病)对患者的心理健康和生活质量构成严重挑战,形成“共病加重治疗负担-治疗效果下降-病情恶化”的恶性循环,显著降低患者的生理功能与心理适应能力。尽管共病对治疗依从性的负面影响在逻辑上显而易见,但直接量化特定共病与治疗依从性关联的高质量临床研究仍然非常有限[10]。全面理解共病如何影响抗肿瘤治疗,对于优化个体化治疗策略、改善患者预后至关重要。 共病对肿瘤患者治疗选择的影响是系统性且多维度的[11],贯穿肿瘤诊疗的全过程,具体表现为:降低肿瘤患者总体生存率、干扰癌症诊疗全流程、限制临床试验的参与、促进肿瘤转移等负面影响。主要原因包括:(1)患者器官功能储备下降限制治疗耐受性;(2)药物代谢相互作用改变抗肿瘤药代动力学;(3)共病引发的慢性炎性反应、代谢紊乱等病理状态可能加速肿瘤细胞增殖、重塑肿瘤微环境[7]。针对合并共病的肿瘤患者,考虑到治疗并发症和不良反应风险增加,临床医生和患者可能倾向于选择更为保守或治疗强度降低的方案,降低患者接受根治性治疗(如手术、根治性放化疗)的机会[8]。另一方面,共病也影响患者接受前沿治疗的机会:临床试验中普遍采用的严格入组及排除标准,往往会将伴有严重共病的肿瘤患者排除在外。这一现象直接造成临床试验所纳入的人群与真实世界中的患者群体存在显著差异,进而使得临床试验结果的外推性受到明显限制,难以全面、有效地指导真实世界中复杂病情患者的治疗实践。 近年研究提示,共病与肿瘤之间可能存在生物学上的协同作用。例如,慢性炎性反应状态[12]、代谢紊乱[13]等共病相关的病理生理过程,可能通过改变肿瘤微环境、激活特定信号通路等机制,直接促进肿瘤的进展和转移,使得肿瘤更具侵袭性。因此,合并多种共病的肿瘤患者,其治疗完成率显著低于无共病患者,使得肿瘤复发、转移的风险增加,进而影响患者的预后[14]。此外,共病本身也会对患者的身体状况产生负面影响。
专家共识3:由于共病全方位地影响到肿瘤治疗的决策、效果和最终结局,为确保患者安全和最佳治疗效果,改善肿瘤共病患者的转归和治疗完成率,本共识专家组对肿瘤共病患者的治疗策略提出以下优化意见: (1)制定肿瘤治疗方案前,对患者进行共病筛查与评估;对患者正在使用的所有药物(包括处方药、非处方药和草药补充剂)进行全面审核;可建立肿瘤内科与相关学科(如心内科、内分泌科等)的协作机制,共同制定治疗方案,平衡抗肿瘤治疗与共病管理。 (2)了解常见共病对各类型抗肿瘤治疗的影响,治疗过程中动态平衡疗效与不良事件风险。 (3)建立长期随访机制,动态评估肿瘤与共病状况,及时调整治疗策略,提升患者生存质量。 共病患者需要同时管理多种疾病,服用多种药物,这增加了患者“药丸负担”(Pill burden)和自我管理的复杂性,容易导致混淆、遗忘或主动放弃部分治疗,导致患者对治疗的依从性降低[15]。 共病的影响远不止于躯体层面,它对患者的心理健康和整体生活质量(QoL)造成了沉重打击。2022至2024年间发表的多项大型横断面研究和荟萃分析证实,肿瘤患者抑郁和焦虑的患病率显著高于普通人群,并严重影响其生活质量[16]。认知行为干预可降低患者焦虑抑郁症状,提高患者的治疗依从性,改善生活质量。研究表明,心理干预(如认知行为疗法)可有效改善肿瘤患者心理状态和治疗依从性。
专家共识4:为提升肿瘤共病患者依从性、促进患者身心健康,本共识专家组建议加强肿瘤患者共病管理及心理干预,减轻患者身心负担,提高治疗依从性。 抗肿瘤治疗过程中,共病的存在使得药物治疗方案更为复杂,抗肿瘤药物与治疗共病药物之间的相互作用已成为影响患者安全和整体疗效的关键因素。多重用药极大地增加了药物-药物相互作用(Drug-drug interactions, DDIs)的风险,可能通过药代动力学(Pharmacokinetics, PK)或药效学(Pharmacodynamics, PD)机制,改变药物的疗效或增加其毒性,从而对患者的治疗结局和生活质量产生重大影响[17]。
专家共识5:肿瘤患者共病药物相互作用的管理对于临床医生来说,是一项复杂且持续的挑战。建议采用电子药物相互作用筛查系统(如DrugBank数据库)进行审核,重点关注CYP450酶相关的代谢相互作用。同时,本共识专家组建议根据共病情况合理选择抗肿瘤药物,调整剂量与给药方式,密切监测药物不良反应及相互作用。
3 肿瘤背景下的共病诊疗及管理
目前临床实践中针对肿瘤背景下共病诊疗的规范化路径仍有待完善,不同学科间的诊疗理念差异、共病评估工具的选择不统一、治疗方案的个体化调整缺乏明确指引等问题,均给临床医师带来了诸多挑战。因此,构建具有临床可操作性的肿瘤共病诊疗原则,对于规范临床实践、优化诊疗策略、保障患者安全具有重要意义。 本章将基于当前国内外最新的临床研究证据及临床实践经验,围绕肿瘤背景下共病诊疗的核心目标,从共病评估的时机与方法、多学科协作诊疗模式的构建、治疗方案的个体化权衡与调整、治疗相关不良反应的监测与管理以及患者长期随访与健康管理等关键维度,提出针对性的诊疗原则建议,旨在为临床医师提供全面、实用的诊疗参考,助力实现肿瘤患者与共病的协同管理,最终改善患者的整体健康结局。 共病种类繁多,综合管理难度大,给肿瘤专科医生带来挑战。在院内诊疗阶段,借助医院信息系统将共病临床路径嵌入日常工作流程,形成临床决策辅助系统,更有助于提高医疗质量,做到全面且有的放矢的个体化患者管理。此外,管理患有多种健康问题的患者可能会导致诊疗信息分散化、碎片化,使治疗缺乏连贯性或风险评估不足。在院外随访阶段,需要调动并增加与初级保健服务的合作、更有效地共享医疗信息、增加社区护理并发挥远程医疗优势。通过定期随访和平台综合管理,及时并高效的进行医疗决策,做到院内与院外共病管理流程的有效衔接和转换。
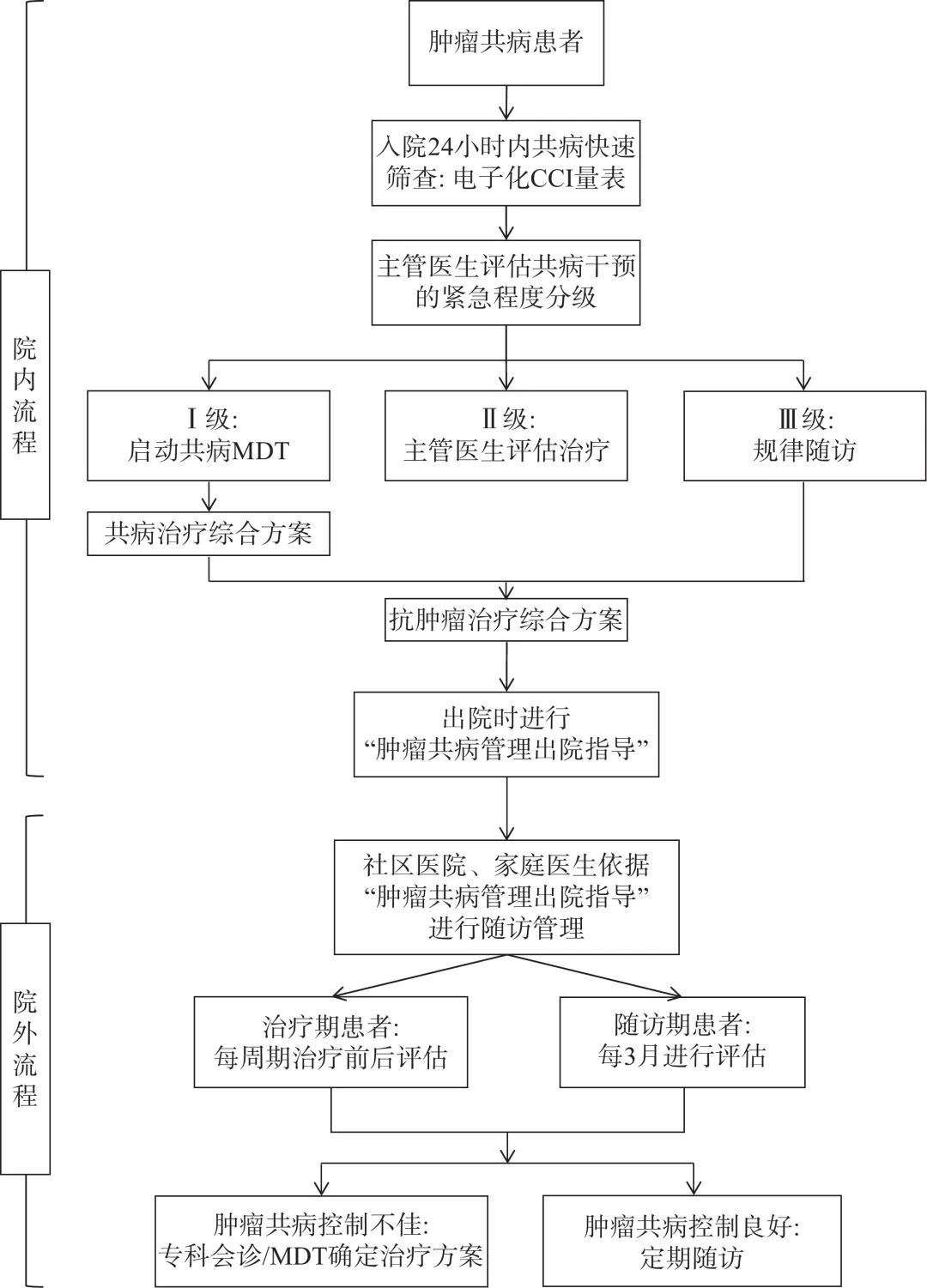
专家共识6:肿瘤患者诊疗的院内阶段,需要肿瘤专科主管医生对患者利用查尔森合并症指数(Charlson comorbidity index, CCI)等工具对肿瘤共病进行量化评估[18](表2~3)。构建制度化的MDT流程是保障诊疗质量、改善患者预后的核心组织保证。符合MDT指征时及时启动流程并制定干预措施,为抗肿瘤治疗尽快创造最佳条件。院外阶段则需要对治疗期和随访期的患者分别制定共病随访计划,并进行有效宣教。治疗期患者建议每个治疗周期前后进行评估、随访期患者建议间隔不超过3个月进行一次共病评估。若期间出现共病状况恶化,需及时进行相关专科诊疗或启动MDT流程。肿瘤共病的评估及随访管理流程,见图1(各系统共病启动MDT时机详见第4章节)。 推荐强度:弱推荐;专家共识度:66.7%。
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | 慢性肾病(eGFR<60 ml/min/1.73 m2)或透析 |
| | |
| | |
| | |
| | 肝硬化(Child-Pugh B/C级)或门脉高压 |
| | |
| | HIV感染伴CD4+ T细胞计数<200/μl或机会性感染 |
4 常见共病诊治原则
肿瘤患者合并共病,并非孤立存在的健康问题,其发生与发展既可能受肿瘤本身病理生理改变的影响,也可能因肿瘤治疗(如化疗药物对胃肠道及肝肾功能的刺激、心脏毒性,靶向药物对肝肾功能、代谢功能的干扰等)而加重,反向制约肿瘤治疗方案的选择、增加治疗相关不良反应风险,并直接影响患者的一般状态、生活质量及整体预后。因此,在面对这类复杂情况时,不能单纯以 “治疗肿瘤” 或 “处理各系统疾病” 为单一目标,而需建立 “肿瘤—共病” 整体管理的思维,在明确共病类型、评估病情严重程度及与肿瘤治疗关联性的基础上,探索兼顾肿瘤控制与共病缓解的诊治路径。以下将围绕各系统常见共病及诊治原则展开,重点阐述如何在肿瘤治疗的大框架下,通过科学评估、精准干预及动态监测,实现共病管理与肿瘤治疗的协同推进,最大程度保障患者的治疗安全性与有效性。
肿瘤患者常见的消化系统共病包括消化性溃疡、肝病及肠病。 肿瘤患者消化性溃疡(Peptic ulcer, PU)发病率尚无大样本文献报告,但一般认为明显高于普通人群。其发病率与肿瘤类型、分期及治疗方式等因素有关。文献报道胃癌患者PU发病率为5%~7%[19],进展期和转移性肿瘤患者PU发病率明显高于早期患者,上腹部放疗的肿瘤患者PU发病率明显升高。上消化道出血、穿孔和消化道梗阻等是PU常见并发症,尽管目前尚无大样本统计报告,但临床实践中,可见到肿瘤及其治疗更易诱发PU出血、梗阻、肠穿孔等。
专家共识7: 肿瘤患者PU发病率高于普通人群,与肿瘤类型、分期和治疗方式有关;在肿瘤患者中出现的PU更易发生出血、梗阻、肠穿孔等并发症。 推荐强度:强推荐;专家共识度:87.5%。
肿瘤与PU的发病机制共享多种共同风险因素。二者的发病机制与幽门螺杆菌(Helicobacter pylori, Hp)、吸烟、遗传、应激等理化和生物因素密切相关,主要通过引发慢性炎性反应、黏膜屏障破坏及修复异常等机制促进疾病发生。肿瘤与PU也可互为诱因,二者存在如下密切且复杂的相互作用: (1)胃溃疡(Gastric ulcer, GU)诱发癌症:GU是胃癌的癌前病变,可经肠化、瘤变等病理过程演变为胃癌[20];长期使用非甾体抗炎药(Non-steroid anti-inflammatory drugs, NSAIDs)是引发PU的重要原因,而长期溃疡和炎性反应环境将增加癌变风险。 (2)肿瘤诱发或加重PU:胰腺癌和胆道系统恶性肿瘤情况下,碱性胆汁或胰液分泌入十二指肠减少,致使排入十二指肠腔内的酸性胃液得不到有效中和,从而增加十二指肠溃疡的发病;各类恶性肿瘤及其治疗都给患者带来显著的身心应激,导致植物神经和内分泌系统紊乱,诱发胃黏膜损伤。放疗、化疗药物和NSAIDs等药物可破坏黏膜屏障,直接诱发或加重上消化道黏膜的损伤。因此,与肿瘤共病的消化性溃疡具有显著的病种特异性和治疗方式依赖性,临床上需要关注消化性溃疡与肿瘤之间的双向促进作用。 肿瘤患者最常见的肝脏疾病包括病毒性肝炎(Viral hepatitis)、酒精性肝病(Alcoholic liver disease, ALD)及代谢相关脂肪性肝病(Metabolic-associated fatty liver disease, MAFLD, 又称nonalcoholic fatty liver disease, NAFLD)。 病毒性肝炎是由多种肝炎病毒感染引起以肝脏损害为主的一组全身性传染病。目前按病原学明确分类的有甲、乙、丙、丁和戊五型。其中乙型肝炎病毒(Hepatitis B virus, HBV)感染是导致肝癌的最主要危险因素[21]。在我国肝癌患者中,HBV相关肝癌占比高,84%的肝癌由HBV感染所致[22]。 ALD是长期大量饮酒导致的进行性肝脏疾病,其疾病谱包括酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化、酒精性肝硬化,严重时可进展为肝细胞癌(Hepatocellular carcinoma, HCC)。ALD与肿瘤关系密切,不仅是肝癌的重要病因(在酒精性肝硬化患者中,肝癌年发病率达2.9%[23],5年和10年HCC累积风险分别为3%和9%[24],较普通人群升高1.51~2.23倍[25]),还因长期酗酒、免疫功能紊乱及营养状态差等因素使患者合并消化道、头颈部等其他系统肿瘤的比例高于普通人群[26]。
专家共识8:慢性肝病是肝细胞癌(HCC)及肝外恶性肿瘤的重要病因。其主要风险因素包括病毒性肝炎(尤其是HBV感染)、酒精性肝病(ALD)以及代谢相关脂肪性肝病(MAFLD)。临床实践中需高度重视对慢性肝炎病毒感染者、长期酗酒者及MAFLD患者的管理,加强肝癌及肝外肿瘤的筛查与监测,以实现早期诊断和干预。 推荐强度:强推荐;专家共识度:87.5%。
消化系统肠道共病谱包括感染性肠炎(Infectious colitis, IC)、放射性肠炎(Radiation enteritis, RE)及炎症性肠病(Inflammatory bowel disease, IBD)。常见的IBD疾病包括溃疡性结肠炎(Ulcerative colitis, UC)及克罗恩病(Crohn’s disease, CD)。 UC是一种慢性非特异性炎性反应性疾病,病变局限于结肠黏膜及黏膜下层,呈连续性、弥漫性分布,从直肠向近端结肠延伸。病程超过10年的UC患者,结直肠癌变(Colorectal Cancer, CRC)风险是病程<10年患者的3.78倍[27]。 CD是一种透壁性炎性反应性疾病,可累及从口腔至肛门的全消化道,典型表现为节段性、跳跃性病变。CD患者存在多部位癌变风险:小肠腺癌的风险高于一般人群(诊断后10年和25年的累积风险分别为0.2%和2.2%)[28],为CD特异性风险,多发生于狭窄或瘘管旁。CD患者发生结肠癌的平均年龄比正常同龄人群提前20年,其发病相对危险度为普通人群的2~3倍[29]。 IC是由病原体(细菌、病毒、真菌或寄生虫)侵袭肠黏膜引起的急性炎性反应。在接受化疗的肿瘤患者中,中性粒细胞减少与免疫抑制状态作为高危因素,显著增加小肠结肠炎发生风险[30],见表4。异基因造血干细胞移植患者原发巨细胞病毒(Cytomegalovirus, CMV)感染及CMV激活率高,可导致出血性结肠炎[31]。
放射性肠炎(Radiation enteritis, RE)是盆腔或腹腔放疗导致的肠道辐射损伤,表现为因胶原代谢异常导致的组织愈合能力下降,以及中性粒细胞趋化障碍导致腹腔感染风险增加。 随着新辅助放化疗技术应用于临床,癌症存活患者的数量增加,放射性肠炎的发病率也随之升高[32]。 肠道共病与消化道肿瘤共享“炎症-癌变”的病理基础,显著增加了肿瘤诊疗的复杂性,导致诊断混淆、治疗选择受限、毒性风险叠加及预后恶化,必须在肿瘤全程管理中给予系统性评估和动态监测。肠道共病与肿瘤的相互作用是双向的。慢性炎症(如IBD、放射性肠炎)微环境是肿瘤发生的“土壤”,通过NF-κB、Wnt/β-catenin等信号通路持续活化、菌群-免疫轴失衡(如具核梭杆菌富集)及表观遗传修饰异常等多种机制,促进肿瘤发生、侵袭和免疫逃逸。感染性肠炎则通过病原体介导的免疫逃逸促进肿瘤发展并降低免疫治疗的疗效。同时,抗肿瘤治疗可通过直接黏膜毒性或免疫介导机制,诱发或加重共病,形成恶性循环。
专家共识9:消化系统肠道共病是指在恶性肿瘤诊断前后已存在的、或由抗肿瘤治疗诱发的慢性肠道疾病,常见于炎症性肠病、放射性肠炎及感染性肠炎等。其与消化道肿瘤共享“炎症-癌变”的病理基础,显著增加了肿瘤诊疗的复杂性,导致诊断混淆、治疗选择受限、毒性风险叠加及预后恶化,必须在肿瘤全程管理中给予系统性评估和动态监测。 推荐强度:弱推荐;专家共识度:79.2%。
上消化道肿瘤早期症状常不特异,可出现纳差、腹胀、早饱、嗳气等消化不良症状,易与PU混淆。对于年龄≥40岁、有肿瘤家族史、新发消化不良症状或与既往PU症状有差异、有消瘦等肿瘤报警症状时,应提高鉴别诊断意识[33]。长期使用NSAIDs或抗血小板药物的中老年患者,若出现消化不良或消化道出血表现,应行内镜检查以加以鉴别。此外,因肿瘤及其治疗可诱发和加重PU,在肿瘤治疗之前,对有PU病史或存在PU相关症状者,应鉴别是否合并PU,必要时行胃镜检查,以明确溃疡分期。在肿瘤进展或治疗过程中,若出现消化不良、上腹痛、恶心呕吐、反酸烧心甚至反食等症状,应加强PU等上消化道共病的诊断和鉴别,胃镜或上消化道造影检查有助于明确诊断。化疗最常见的不良反应表现为化疗相关性恶心呕吐(Chemotherapy-induced nausea and vomiting, CINV),但在临床实践中,可见到化疗后由于消化道黏膜炎性反应水肿或溃疡加重,发生上消化道器质性梗阻,而被误诊为CINV的情况,应注意鉴别[34]。
专家共识10: 既往有PU病史或新发PU症状者,在肿瘤治疗前,应明确PU诊断和分期。肿瘤早期症状不典型时常与PU症状重叠,易导致误诊。对于与既往PU症状不同、伴有肿瘤报警症状者,应警惕肿瘤的可能;PU有发展为癌性溃疡的可能,可通过内镜检查、多点挖掘式活检以及对PPIs的治疗反应鉴别,久治不愈的PU应警惕恶性病变;肿瘤进展或治疗过程中出现新发消化道症状,应警惕PU加重。 推荐强度:强推荐;专家共识度:87.5%。
病毒性肝炎、酒精性肝病及代谢性脂肪肝均可通过诱导慢性炎性反应、遗传损伤及微环境紊乱等多种机制,促进肝细胞癌及其他肿瘤的发生。反之,肿瘤本身及其治疗又可加剧肝功能损伤,加速肝病进展,增加肝衰竭风险。因此,临床应对慢性肝病患者加强肿瘤筛查,并对肿瘤患者常规评估肝功能,通过肿瘤与共病一体化管理策略改善患者预后。 当恶性肿瘤患者出现肝功能异常、乏力、黄疸或腹水等症状时,应高度警惕病毒性肝炎、ALD或MAFLD的可能,并立即进行同步筛查。对于病毒性肝炎,可通过肝炎病毒标志物(如乙肝表面抗原、丙肝抗体)、病毒核酸检测(HBV DNA、HCV RNA)及肝功能检查(ALT、AST升高)等综合判断[35]。对于ALD,需详细询问饮酒史,结合实验室检查(如AST/ALT比值>2、GGT升高、MCV增高等)及影像学检查(肝脏超声或CT显示脂肪浸润、肝硬化和门脉高压征象)[36]。MAFLD的诊断则需依据代谢异常背景(肥胖、2型糖尿病、血脂异常等),结合肝脏超声或MRI提示脂肪肝[37],并排除其他肝病原因。必要时可通过瞬时弹性成像检测肝脏硬度,评估纤维化程度。在恶性肿瘤治疗过程中,应动态监测肝功能、凝血功能、腹部影像学及肝纤维化指标,定期评估肝病进展,及早发现肝损伤或肝硬化并发症,有助于早期发现肝病进展或恶化,为治疗方案调整提供依据。 对于慢性HBV感染者,国际上常采用基于Knodell、Scheuer评分系统基础上细化的Metavir或Ishak评分系统[38-41]评价患者的肝组织炎症坏死分级和纤维化分期。我国沿用的评分系统为慢性肝炎分级(G0~4)、分期(S0~4)系统[42],该系统能较好地反映慢性肝炎的病变程度,特别适用于其疗效的统计、分析和比较。 对于ALD患者,临床推荐采用肝功能Child-Pugh分级与终末期肝病模型(Model for end-stage liver disease, MELD)评分,联合评估肝损伤的严重程度及不同损伤级别对肿瘤治疗的影响。为指导共病患者实施个体化治疗,建议将两者协同应用:Child-Pugh分级用于明确基线肝功能状态,MELD评分则用于动态监测治疗期间(如肿瘤治疗后)的病情风险变化;同时需系统评估ALD相关并发症(如腹水、肝性脑病等),此类并发症可能显著增加肿瘤治疗过程中的不良风险[43]。 对于MAFLD患者,临床推荐对其进行肝纤维化的分期与风险评估。肝纤维化通常分为四期(F0~F4),根据其严重程度和临床管理策略,可归为三个层级:F0~F1(无或轻度纤维化)、F2(显著纤维化)、F3~F4(进展期纤维化/肝硬化)。对进展期纤维化(≥F3)的风险评估流程,推荐肝纤维化4项(FIB-4)与肝硬度值(LSM)的联合应用:FIB-4<1.3、LSM<8 8="" 12="" fib-4="">2.67、LSM>12 kPa-高危[44]。
专家共识11:对于合并慢性肝病的恶性肿瘤患者,应及早通过病史、实验室及影像学检查明确肝病诊断与严重程度,并注意与肿瘤本身所致肝损伤相鉴别,根据肝功能储备及肝病分期评估结果指导抗肿瘤治疗。对于病毒性肝炎患者,我国沿用慢性肝炎分级系统,可反映慢性肝炎的病变程度;对于ALD患者,推荐协同应用肝功能Child-Pugh分级与MELD评分,联合评估肝损伤的严重程度及不同损伤级别对肿瘤治疗的影响;对于MAFLD患者,推荐进行肝纤维化的分期与风险评估。 推荐强度:强推荐;专家共识度:83.3%。
面对消化道症状、内镜及影像学表现的非特异性挑战,可综合运用时序性分析(如治疗反应)、精细内镜评估(如ICIs肠炎分级)、多模态影像(如DWI-MRI的ADC值、PET-CT的SUVmax)及分子病理检测(如MSI/MMR状态、CMV组化、粪便毒素PCR)等多种手段,以鉴别肿瘤发生或复发、肠道共病急性加重或治疗相关毒性,避免误诊误治。 UC的诊断标准为:结肠镜检查显示黏膜脆性增加、接触性出血、弥漫性糜烂;组织病理显示隐窝脓肿、杯状细胞减少;生物标志物检测:粪便钙卫蛋白水平可提示UC炎症活动度[45]。 CD的诊断标准为:节段性深溃疡、鹅卵石样改变、狭窄性病变;组织病理显示非干酪样肉芽肿、透壁性炎性反应;CD特异性生物标志物检测:血清抗酿酒酵母抗体(Anti-saccharomyces cerevisiae antibody, ASCA)阳性。 放射性肠炎的诊断依据为:具有盆腔/腹腔放疗史(剂量>45 Gy);急性期RE内镜特征表现为黏膜充血、水肿,慢性期表现为苍白、毛细血管扩张、脆性增加;CT肠造影显示肠壁增厚(>3 mm)、脂肪间隙模糊;MRI可见肠系膜纤维化(T2加权高信号)。 艰难梭菌感染的肠炎特征为:粪便谷氨酸脱氢酶(GDH)阳性、毒素PCR阳性;内镜见黄色伪膜。 CMV结肠炎特征为:血清CMV-DNA>1000 IU/ml;组织免疫组织化学显示核内包涵体CMV阳性。
在肿瘤治疗前应明确溃疡分期:活动期溃疡应先治疗溃疡2~4周,待复查胃镜证实溃疡明显缩小或愈合成疤痕后,再进行肿瘤治疗。质子泵抑制剂(Proton pump inhibitors, PPIs)是PU最主要的治疗药物之一,通过多种机制对抗肿瘤药物产生影响。PPIs因其可强烈抑制胃酸分泌,可改变胃肠道酸碱性环境,影响口服药物的吸收,并对胃肠道菌群的定植产生明显影响,继而可能影响免疫检查点抑制剂的临床效果[46]。既往多项临床与药理学研究表明,PPI通过显著升高胃内pH值,改变口服化疗药物(如卡培他滨)的溶解度与生物利用度。PPIs和多种抗肿瘤药物通过肝酶代谢(如CYP2C19和CYP3A4等)相互干扰,而人群中CYP2C19存在多态性,对药物效果和不良反应进一步产生复杂影响。目前临床使用的PPIs有十余种,某些PPIs(如泮托拉唑)具有“双通道代谢”特征,即同时经CYP2C19和CYP3A4两条途径代谢,当基因多态性不利于其代谢(如CYP2C19慢代谢型)或某一种肝酶被竞争抑制时,另一条途径仍可代偿,降低PPIs药物在体内蓄积的风险,并减少对其他经肝酶代谢药物的影响。相比依赖单一通道代谢的PPIs(如奥美拉唑、埃索美拉唑等),具有“双通道代谢”特征的PPIs对经CYP酶代谢的抗肿瘤药物(如紫杉醇、伊立替康、伊马替尼)和支持治疗药物(如昂丹司琼、地塞米松)干扰更小,因此当肿瘤患者需长期抑酸治疗时,优先推荐使用具有“双通道代谢”特征的PPIs[47] 。PPIs还可通过抑制肿瘤细胞V-ATPase及肾小管OCT2转运蛋白,增强部分化疗药(如顺铂、阿霉素)疗效[48]。此外,长期PPIs使用可能增加骨折、感染、肾损伤及营养缺乏等风险。 癌痛是肿瘤常见症状,根据WHO推荐,非甾体抗炎药(Non-steroidal anti-inflammatory drugs, NSAIDs)是治疗癌痛的主要药物之一。布洛芬、阿司匹林、吲哚美辛等非选择性NSAIDs可通过抑制环加氧酶1/2(Cyclooxygenase, COX-1/COX-2)活性,减少胃黏膜保护性前列腺素E2(prostaglandin E2,PGE2)的合成,从而削弱黏膜屏障、诱发黏膜炎性反应和溃疡。而选择性COX-2抑制剂,可抑制促炎及致痛介质的产生,而不影响PGE2合成,对PU影响较小[49]。
临床问题12:对消化性溃疡共病患者遵循治疗优化原则,进行个体化的治疗策略调整 专家共识12:存在活动期PU者,应优先治疗PU,同时肿瘤治疗过程中注意消化道功能和黏膜保护;肿瘤治疗应优先于幽门螺杆菌(Hp)进行根除治疗。PPIs对肿瘤药物治疗有相互影响,在使用经肝酶途径代谢的抗肿瘤药物的情况下,应优先考虑使用具有“双通道代谢”特征的PPIs;癌痛治疗中,优先考虑使用选择性COX-2抑制剂以减少对PU的影响。 推荐强度:弱推荐;专家共识度:66.7%。
肝脏共病患者的抗肿瘤治疗应严格依据肝病严重程度对抗肿瘤方案进行个体化选择与剂量调整,并同步加强戒酒、代谢基础治疗以降低肝损伤风险。HBV相关肝癌患者在抗肿瘤治疗前需接受预防性抗病毒治疗,并在抗肿瘤治疗全过程中动态调整抗病毒治疗方案。对肝脏共病患者应秉持“协同获益、风险分层”原则,进行个体化的抗肿瘤治疗策略调整与剂量优化,见表5。
| | | |
| 抗癌治疗前复查 HBSAg、HBcAb、HBV DNA,治疗过程严密监测病毒水平,必要时预防性抗病毒治疗、长期抗病毒治疗 | | |
|
|
|
|
| HBsAg阳性者术前启动一线抗病毒药物。肝功能失代偿患者(Child-Pugh B/C级)需在抗病毒治疗基础上给予保肝治疗,恢复至Child A级后择期手术 | Child-Pugh A级:无严重门脉高压者可行肝切除(切除量<50% 肝体积)
Child-Pugh B级:符合单个肿瘤直径<5 cm、无血管侵犯等标准者,优先考虑射频消融或肝移植
Child-Pugh C级:禁止手术 | F0~F1:风险同普通人群
F2:需全面评估
F3~F4:风险极高,严格限制
手术 |
| HBsAg(+)者行TACE/HAIC前必须启动一线药物抗病毒治疗;HBsAg(−)但抗-HBc(+)者行高强度化疗时建议抗病毒治疗 | Child-Pugh A级:可用低肝毒性药
Child-Pugh B级:化疗减量50%~75%,优选靶向/免疫治疗
Child-Pugh C级:禁用常规化疗及大部分靶向药,仅危急且无替代方案时考虑使用 | F0~F1:常规剂量,警惕肝毒性药物
F2:避免高肝毒药物,需减量、监测
F3~F4:禁用高肝毒药,优选肾排泄药,减量≥50% |
| | Child-Pugh A级:耐受良好,基线监测肝功能及自身抗体Child B/C级:慎用ICI,治疗中每2~4周监测 | F0~F2:耐受良好,基线监测肝功能及自身抗体
F3~F4:慎用ICI,治疗中每2~4周监测 |
| | Child-Pugh A级:常规剂量
Child-Pugh B级:剂量降低20%~30%,缩小照射野
Child-Pugh C级:仅行姑息治疗,需肝病科支持 | F0~F1:常规剂量
F2:剂量降低20%~30%,缩小照射野
F3~F4:仅行姑息治疗,需肝病科支持 |
部分IBD治疗有增加肿瘤发生及转移的风险,需及时调整治疗方案,促瘤风险的IBD治疗方案调整见表6。需要接受化疗的放射性肠炎患者,应谨慎审查药物,调整化疗药物和剂量,放射性肠炎患者的化疗方案见表7。
临床问题13:肠道共病个体化的治疗策略调整与剂量优化 专家共识13:治疗决策需根据共病类型、严重程度及肿瘤紧迫性,严格调整治疗方案。IBD活动期或放射性肠炎急性期应谨慎选择或暂停高风险治疗(如英夫利西单抗、贝伐珠单抗、5-Fu);对于IBD合并肿瘤患者,应避免使用已知会增加淋巴瘤或转移风险的免疫抑制剂(如硫唑嘌呤、JAK抑制剂),并寻求替代方案,始终平衡抗肿瘤治疗获益与共病恶化风险。 推荐强度:弱推荐;专家共识度:79.2%。
4.1.4 肿瘤合并消化系统共病管理与MDT启动时机建议在肿瘤确诊时做消化系统基线评估,包括以下三个方面: (1)详细询问既往溃疡/消化道出血史、NSAIDs/抗血小板/抗凝药史及胃切除史;必要时行胃镜评估、Hp检测(尿素呼气/粪抗原/胃镜活检三选一)[50]。 (2)筛查肝病(肝功能、影像学、纤维化评估),明确共病诊断与分级,制定个体化方案并动态监测。 (3)根据高危指征,对IBD伴肿瘤进行随访监测,见表8。对于慢性放射性肠炎,建议每年1次小肠CT造影以评估狭窄程度;并且每3个月检测血清营养指标(白蛋白、前白蛋白)。
MDT团队组成建议包括:肿瘤内科、放疗科、病理科、普外科、消化内科、肝病感染科、介入科、营养科。构建制度化的MDT流程是保障诊疗质量、改善患者预后的核心组织保证。 MDT启动时机:当肿瘤患者合并消化道共病出现以下指征时,建议启动相应的多学科协作,为患者制定个体化管理方案。 (2)中重度肝病(Child-Pugh B/C、F3~F4); (5)肝硬化并发症(腹水、肝性脑病)或HCC治疗决策; (6)盆腔放疗后出现慢性腹泻>3个月伴体重下降>10%或反复肠梗阻发作; (8)恶性肿瘤治疗过程中出现共病与肿瘤相互影响的其他复杂情况。
4.2 呼吸系统常见共病诊治原则
肿瘤患者合并呼吸系统的常见共病谱包括肺炎、慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)及间质性SS肺疾病(Interstitial lung disease,ILD)等。 肺炎是一种由细菌、病毒、真菌等病原体所致的感染性肺实质炎性反应,在影像学上表现为新近出现的肺部浸润影。在临床处理中需与放射性肺损伤、药物性肺损伤、免疫性肺损伤等非感染性炎性反应相鉴别。恶性肿瘤患者的生存期不断延长,伴发肺炎风险升高。不同类型肿瘤及其相应的治疗方案对肺炎风险的影响各异,已知我国肺癌患者的肺炎发病率约为53%[51-52]。肺炎的发生和处理不当将影响抗肿瘤治疗和患者生活质量及生存期[51]。 COPD是一种具有气流阻塞特征的慢性支气管炎和(或)肺气肿,可进一步发展为肺心病和呼吸衰竭的常见慢性疾病,具有高患病率、高致残率、高死亡率的“三高”特点[52]。COPD是肺癌的独立危险因素。肺癌合并慢性阻塞性肺疾病(Lung cancer combined by chronic obstructive pulmonary disease,LC-COPD)不仅显著降低患者生活质量,增加疾病全病程管理的复杂性与挑战性,更增加患者死亡风险,对预后产生不利影响[53]。 ILD是以肺部间质炎性反应和纤维化为病变的肺部疾病总称。临床主要表现为进行性加重的呼吸困难和低氧血症,肺功能损害以限制性通气功能障碍、弥散功能降低为主要特点。特发性肺纤维化(Idiopathic pulmonary fibrosis, IPF)是ILD中最常见的类型。ILD同样也是肺癌的独立危险因素[54]。
临床问题14:确立呼吸系统共病定义并高度重视呼吸共病的普遍性与负面影响 专家共识14:呼吸系统共病是指在恶性肿瘤诊断前后已存在的、同时与肺癌共享危险因素(如吸烟)、并可与肺癌产生复杂相互作用的慢性肺部疾病。常见于肺炎、COPD、ILD等。其高患病率显著增加了恶性肿瘤诊疗的复杂性,导致诊断延迟、治疗选择受限、毒性风险增加及总体预后恶化,必须给予与恶性肿瘤本身同等程度的关注和系统性评估。 推荐强度:强推荐;专家共识度:87.5%。
呼吸系统共病与肺癌之间的作用是双向的。肺炎、COPD、ILD中的慢性炎性微环境是肿瘤发生的“土壤”,通过活性氧、细胞因子等多种机制促进肿瘤发生、侵袭和免疫逃逸。同时,肺癌可通过梗阻、治疗不良反应及肿瘤本身生物学行为导致的阻塞性肺炎等,诱发或加重共病。 当恶性肿瘤患者出现相关呼吸系统症状时,应立即同步进行肺炎、COPD、ILD的筛查。对于肺炎,可通过症状(发热、咳嗽、咳痰等)、血常规、C反应蛋白、胸部影像学(如胸部X线、CT)等检查结果综合判断[55]。COPD则主要依据肺功能检查(FEV1/FVC<70%)[56],结合胸部CT观察肺气肿、气道壁增厚等表现。ILD的筛查则需依靠高分辨率CT观察肺部磨玻璃影、网格影、蜂窝肺等特征,结合肺功能检查(限制性通气功能障碍、弥散功能降低)等[57]。 肺炎、COPD、ILD常需要与原发性肺癌或转移性肺癌进行鉴别诊断。经验性抗感染治疗和动态影像学评估有助于鉴别诊断,病原学检测及肺组织病理活检可以明确诊断[58]。恶性肿瘤治疗过程中,需动态监测呼吸系统共病情况,强化鉴别诊断意识。定期复查胸部影像学、肺功能、炎症指标等,有助于早期发现共病变化[59]。 当鉴别肺部肿瘤、呼吸系统共病急性加重或治疗相关毒性时,常面临症状和影像学重叠的挑战。为解决这一问题,需综合运用时序性分析评估抗感染治疗反应、精细影像判读以追踪影像学动态变化、肺功能评估及审慎应用有创检查等多种手段进行鉴别诊断。
呼吸系统共病会显著影响肿瘤患者的抗肿瘤决策、疗效、不良反应和预后。实体瘤患者在接受手术前均需常规接受肺部影像学及肺功能评估。化疗前应进行总体感染风险评估,对于感染中/高风险患者,建议考虑预防性使用抗感染药物。目前暂无研究明确指出需行化疗的肺炎患者重新启动化疗的时机。建议在急性期病情得到控制、患者症状完全缓解及评估病情符合化疗要求后再重新启动化疗[60]。实体瘤患者在放疗过程中若出现肺炎,建议暂停放疗而先予以抗感染治疗[55]。在抗感染治疗前,应与放射性肺炎等非感染性疾病进行鉴别。目前对于伴发肺炎的肿瘤患者重启放疗的时机暂无明确推荐,可待中性粒细胞减少等危险因素得到纠正、肺炎症状明显改善、影像学病灶明显吸收后再重启放疗。越来越多的证据表明,抗菌药物治疗会对肿瘤免疫治疗效果产生负面影响。因此,在接受免疫治疗的患者中,应尽可能避免使用广谱抗菌药物[61]。对于发生严重肺炎的患者,建议暂停靶向治疗,待病情稳定及相关实验室指标恢复正常后再重新启动。此外,真菌感染时需特别注意部分靶向药物与中强效CYP3A4抑制剂合并使用时的剂量调整[62]。
临床问题15:对呼吸共病患者秉持“安全优先”原则,进行个体化的治疗策略调整与剂量优化 专家共识15:根据共病类型和严重程度,审慎调整治疗方案。治疗方案制定时,需充分考虑共病对肺癌治疗耐受性的影响及肺癌治疗对共病的诱发作用,平衡抗肿瘤治疗获益与共病风险。 (1)推荐所有实体瘤患者治疗前均需接受详尽的呼吸系统评估(包括影像学与肺功能检测)。 (2)合并肺炎时,放疗、靶向及免疫治疗均可能需根据感染风险动态评估,必要时暂停,予以抗感染治疗至感染有效控制后再重启;接受免疫治疗的患者应尽可能避免使用广谱抗菌药物。 (3)合并COPD患者需依据肿瘤临床分期、病理学类型、PS评分、肺功能评估和COPD状态,分级制定化疗、免疫治疗和靶向治疗方案,见表9。(4)合并ILD治疗需极度谨慎:手术前应严格选择手术方式,充分进行围术期评估;放疗必须调整剂量并密切监测ILD的发生;化疗、免疫治疗与靶向治疗需优选肺毒性低的药物并警惕药物可能引起的不良反应。推荐对ILD进行分级管理,见表10。 推荐强度:弱推荐;专家共识度:66.7%。
表 9 依据COPD分级建议肿瘤-COPD共病患者抗肿瘤治疗方案 | | |
|
| 术前进行肺功能检测评估COPD严重程度
肺康复训练,改善肺功能,降低术后并发症风险 |
| | |
|
| 局部晚期非小细胞肺癌合并COPD患者可采用常规放疗,重点关注肺
功能评估和监测
接受放疗时应重点关注肺功能评估和监测 |
| | 首先处理COPD,待症状改善且PS评分≤2分后行免疫治疗 |
| 谨慎采用双免、免疫联合抗血管生成治疗和免疫联合放疗的治疗方案 |
| |
| | EGFR-TKI及ALK-TKI可显著延长该类患者的生存期 |
表 10 依据ILD分级建议肿瘤-ILD共病患者抗肿瘤治疗方案 | | |
|
| 术前对LC-ILD患者肺癌的分期、位置、心肺功能及重要脏器充分进行围手术期评估,谨慎选择手术治疗。可考虑围手术期服用吡非尼酮,降低术后急性IPF的风险 |
|
| |
|
| |
| | 密切监测,3~4周后复查胸部CT
如影像学好转,密切随访并恢复治疗
如影像学进展,暂停ICI治疗
如影像学无改变,考虑继续治疗并密切随访直至出现新的症状 |
| 暂停ICI治疗,直至降至≤G1级
开始激素治疗,如静脉滴注甲泼尼龙;若症状无改善,按G3~4级反应治疗
3~4周后复查胸部CT,若改善至≤G1级,可在评估后恢复免疫治疗 |
| |
| | TKI类药物:密切监测;如果恶化,按G2级或G3~4级治疗 |
ADC类药物:暂停给药直至完全恢复
恢复时间≤28 d可维持原剂量继续用药
恢复时间>28 d则应降低 1个剂量水平继续用药 |
| |
|
| |
| ADC类药物:永久停药,住院并立即开始大剂量甲泼尼龙静脉滴注治疗 |
| 注:G1级为无症状;G2级为病情恶化或出现新的症状;G3级为症状严重或危及生命。 |
4.2.4 肿瘤合并呼吸系统共病管理与MDT启动时机
肿瘤合并呼吸系统共病患者的诊疗管理流程如下:恶性肿瘤确诊后,即刻完善胸部高分辨率CT、肺功能、血常规、凝血功能、肿瘤标志物等检查,全面筛查肺炎、COPD、ILD。依据检查结果,明确共病诊断,并对肺癌及共病进行病情分级,根据肺癌与共病情况,制定个体化治疗方案。 MDT团队组成建议包括:呼吸科、肿瘤科、胸外科、影像科、病理科、药剂科等多学科专家,共同制定治疗方案,平衡肿瘤治疗与共病管理[63-64]。管理恶性肿瘤和呼吸系统共病必须依赖专业、高效的MDT团队。 呼吸系统共病MDT启动时机包括:(1)初诊肺癌合并重症肺炎、中重度间质性肺病(如肺功能严重受损、有急性加重风险)或COPD急性加重期(需机械通气等);(2)恶性肿瘤治疗过程中出现共病与肿瘤相互影响的复杂情况,如肺癌化疗诱发间质性肺病、靶向治疗导致严重肺炎,以及COPD急性加重影响放疗计划。
4.3 心血管系统常见共病诊治原则
肿瘤患者合并高血压、冠心病、心力衰竭、心律失常等心血管系统共病,其病情复杂性远超单一疾病范畴。一方面,肿瘤本身引发的全身炎性反应、血液高凝状态及代谢紊乱,可能诱发或加重心血管损伤;另一方面,肿瘤治疗手段进一步增加了心血管事件(如蒽环类化疗药的心肌毒性、抗血管生成药物对血压的影响、胸部放疗的脱靶效应等)的发生风险,该风险不仅可能迫使肿瘤治疗剂量降低或中断,更可能因急性心血管事件危及患者生命。因此,面对这类 “肿瘤−心血管” 共病患者,需打破学科壁垒,摒弃 “重肿瘤治疗、轻心血管管理” 的传统观念,建立多学科协作的整体管理模式。在全面评估患者心血管基础状况、肿瘤治疗相关心血管风险等级的前提下,探索既能保障肿瘤治疗顺利推进,又能有效防控心血管事件的诊治策略。以下将围绕高血压、冠心病、心力衰竭等常见心血管系统共病的诊治原则展开论述,重点阐述如何在肿瘤治疗全周期中,通过风险分层、个体化干预及动态随访,实现心血管安全与肿瘤疗效的平衡,为患者争取更优的生存预后与生活质量。
4.3.1 常见心血管共病
心功能障碍是多种心脏病的并发症,最终导致心衰(Heart failure, HF),是肿瘤患者中常见的预存共病[65],其存在显著增加了患者对癌症治疗相关心肌功能障碍(Cancer therapy-related dysfunction, CTRCD)的易感性。肿瘤化疗中蒽环类药物,常引起剂量依赖性、不可逆的Ⅰ型CTRCD[66],其特点是心肌细胞死亡和功能永久性损伤;抗HER2靶向药物则多导致Ⅱ型CTRCD,其心肌功能障碍通常可逆[67];此外,免疫检查点抑制剂(ICIs)可导致一种罕见但可能致命的急性心肌炎,其特点是发病急、进展快,可迅速导致严重心功能不全、心律失常甚至心源性休克[68]。 高血压是肿瘤患者中最常见的共病之一。它不仅是独立的严重心血管风险因素,可导致心脏结构和功能改变,还可加重其他心血管疾病的进展。同时,许多抗癌药物如血管内皮生长因子抑制剂和部分酪氨酸激酶抑制剂本身即可显著升高血压[65,69],甚至导致高血压危象,使得高血压管理在肿瘤患者中更具挑战性。 冠状动脉疾病(Coronary artery disease, CAD)包括稳定型心绞痛、不稳定型心绞痛和心肌梗死,在肿瘤患者中普遍存在,与年龄、吸烟、糖尿病、高血压、高脂血症等传统心血管风险因素密切相关。预存的CAD会使患者在接受肿瘤治疗时对心血管毒性更加敏感。此外,某些化疗药物(如氟尿嘧啶类)可引起冠状动脉痉挛,导致急性心肌缺血甚至心肌梗死[70];铂类化合物和部分VEGF抑制剂也与心肌缺血风险增加相关。 肿瘤患者常合并心律失常等心血管共病,其发生与抗肿瘤治疗密切相关。化疗(如蒽环类药物)、靶向治疗(如酪氨酸激酶抑制剂)及免疫治疗可能直接损伤心肌细胞或干扰电生理活动,诱发房颤、QT间期延长或缓慢性心律失常。此类并发症不仅加重患者症状、降低生活质量,还可能导致抗肿瘤治疗中断或剂量调整,进而影响肿瘤控制效果与生存预后。
临床问题16:精准识别肿瘤患者心血管共病的临床价值 专家共识16:心血管疾病是当前世界范围内威胁人类健康的主要原因,也是肿瘤患者中的常见共病。肿瘤患者的心血管共病谱复杂多样,既包括癌症诊断前已存在的心血管疾病(Pre-existing Cardiovascular Diseases),也涵盖癌症治疗期间及之后新发的心血管并发症,可表现为心律失常(如QT间期延长、房颤)、心功能障碍与心衰、高血压、CAD、心肌缺血与梗死、血栓栓塞与外周血管性疾病等。识别肿瘤患者心血管疾病共病谱,是实施精准心血管肿瘤学管理的基础,有助于优化治疗策略并改善患者预后。 推荐强度:强推荐;专家共识度:87.5%。
肿瘤与心血管疾病在共同风险因素、病理生理学以及治疗干预方面存在复杂且双向的相互作用。首先,二者均存在年龄、吸烟、肥胖等共同风险因素,并通过慢性炎性反应等协同效应加剧彼此进展。其次,肿瘤可通过直接侵犯、转移、副肿瘤综合征、高凝状态及恶病质等多种途径直接或间接损伤心血管系统。同时,预存心血管疾病会增加抗肿瘤治疗的复杂性,限制治疗方案选择,并因治疗中断而影响肿瘤预后。而部分具有明确心血管毒性的抗肿瘤治疗(如化疗、靶向、免疫及放疗),可通过细胞毒性、内皮功能障碍及免疫介导等机制引发多种心血管疾病。了解共病相互作用机制有助于指导临床实践中对风险的评估、并发症的预防和治疗策略的制定。
4.3.2 心血管共病的诊断及鉴别
肿瘤治疗前,所有将接受潜在心血管毒性肿瘤治疗的患者,均应进行全面的心血管风险评估和基线检查。包括详尽的病史询问、体格检查、心电图、心肌生物标志物(如肌钙蛋白、BNP/NT-proBNP)以及心脏超声(评估左心室射血分数(Left ventricular ejection fractions, LVEF)和全局纵向应变(Global longitudinal strain, GLS))[65,71]。在肿瘤治疗期间,应根据治疗方案的已知毒性谱和患者的风险分层,定期动态监测心肌生物标志物、血压、心电图及心脏超声,以及时发现心律失常、亚临床心肌损伤或功能异常。当患者出现新发或加重的心血管症状时,需立即启动快速、全面的心血管评估,包括临床症状评估、心电图、生物标志物检测、心脏超声、MRI等检查,以明确诊断并指导干预[65,72]。 肿瘤患者的症状往往复杂且非特异性,因此鉴别诊断在心血管共病管理中尤为重要,需区分症状是由肿瘤本身、肿瘤治疗相关毒性还是预存心血管疾病所致[73]。例如,呼吸困难需鉴别心源性(心力衰竭、心包积液)、肺源性(肿瘤进展、肺部感染、间质性肺炎)、贫血、体能下降或药物副作用等。胸痛可能提示心绞痛(冠心病、药物诱发血管痉挛)、肺栓塞、肋间神经痛、骨转移痛、心包炎或食管疾病。水肿需鉴别心力衰竭、肾功能不全、肝功能不全、静脉血栓、药物副作用或低蛋白血症。心悸则需排除贫血、体位性低血压、肿瘤进展或电解质紊乱等情况。为确保准确诊断,应采取系统的鉴别诊断策略:首先进行详尽的病史采集和体格检查,了解原有疾病史、用药史、肿瘤治疗方案、症状出现时间与特征;其次进行全面的实验室检查,包括心肌标志物、电解质、肝肾功能、甲状腺功能和血常规。对复杂病例应及时提请多学科会诊(MDT)讨论,通过整合多方专家意见进行综合判断。
临床问题17:抗肿瘤治疗前为患者建立系统性心血管监测体系,在诊疗全过程中强化鉴别诊断,以明确心血管症状病因 专家共识17:对拟接受具有心血管毒性风险的抗肿瘤治疗患者,应建立贯穿治疗全过程的系统性心血管监测体系。治疗前,所有患者均需完成包括详细病史采集、体格检查、心电图、心肌生物标志物(肌钙蛋白、BNP/NT-proBNP)及心脏超声(评估LVEF与GLS)在内的基线评估。治疗中,需依据风险分层与方案毒性,定期、动态复查上述指标。一旦出现新发或加重的心血管症状,需立即启动包含临床症状、心电图、生物标志物、心脏超声乃至心脏MRI在内的快速全面评估。诊疗全过程应高度重视鉴别诊断,精确区分症状源于肿瘤本身、治疗毒性或预存心血管疾病,尤其在症状非特异时。
4.3.3 肿瘤合并心血管共病的诊治原则
为实现肿瘤与心血管共病患者的最佳管理,应遵循一系列治疗优化原则。首先,优化管理预存心血管疾病至关重要。在启动潜在心血管毒性肿瘤治疗前,应积极控制高血压、糖尿病、血脂异常等心血管风险因素,并优化心力衰竭、冠心病等预存心血管疾病的治疗,使其达到最佳稳定状态,从而降低CTRCD的发生风险和严重程度。其次,需进行个体化肿瘤治疗方案[74]。对于高心血管风险患者,在不影响肿瘤疗效的前提下,应优先选择心血管毒性较低的肿瘤治疗方案,如使用脂质体蒽环类药物、调整蒽环类药物的给药方式。第三,对于特定高风险患者,可考虑预防性应用右雷佐生(Dexrazoxane),以降低蒽环类药物治疗的心脏毒性[75]。此外,要高度警惕并避免药物相互作用,因为肿瘤药物与心血管药物之间可能存在复杂的相互作用,如增加QT间期延长的风险、通过细胞色素P450酶代谢途径产生相互影响等[74,76],必要时查阅药物相互作用数据库并咨询临床药师。
临床问题18:对心血管共病患者遵循一系列治疗优化原则,进行个体化的治疗策略调整与剂量优化 专家共识18:对肿瘤与心血管共病患者的管理需遵循系统的治疗优化原则。抗肿瘤治疗前应积极优化预存心血管疾病,控制各项风险因素至稳定状态。肿瘤学专家和心血管病学专家协调制定个体化抗肿瘤方案,对高风险患者优先选择心血管毒性较低的药物(如脂质体蒽环类)或调整给药方式,必要时预防性使用心脏保护药物(如右雷佐生)。抗肿瘤治疗中需严密监测,并依据心功能实施分级干预:轻度CTRCD(无症状,LVEF轻度下降但仍高于50%)可继续治疗并加强监测,以便及时启动心脏保护治疗(如ACEI/ARB、β受体阻滞剂);中度CTRCD(有症状或LVEF下降至40%~49%,非严重CTRCD)应暂停治疗并启动心脏保护治疗;严重CTRCD(如急性心肌炎、严重心力衰竭)需立即停止抗肿瘤治疗并积极进行心脏支持治疗,必要时转入重症监护室。同时需注重心血管药物的合理调整,在确保肿瘤治疗有效性的前提下,最大程度地保护心血管功能,并优化共病药物治疗的剂量。
4.3.4 肿瘤合并心血管系统共病管理与MDT
MDT的组成通常包括肿瘤内科医生、放射肿瘤科医生、心脏科医生、药师、影像科医生、病理科医生、全科医生及其他相关专科医生。对于高风险患者或计划接受高毒性肿瘤治疗的患者,尤其应由MDT共同制定最佳治疗方案,并向患者充分解释风险与获益。 建议为心血管共病建立以多学科协作(MDT)为核心的全流程动态管理路径。MDT启动时机包括: (1)肿瘤治疗前:肿瘤专科医生完成肿瘤诊断、治疗计划及心血管风险分层(高风险患者联系心内科会诊评估)后,首次启动MDT共同制定诊疗方案; (2)肿瘤治疗期间:一旦患者出现新发或心血管症状、体征异常或生物标志物/心功能异常,应请心内科评估并启动 MDT,以讨论并发症管理、肿瘤治疗调整及预后评估; (3)肿瘤治疗后:长期生存者出现放疗相关迟发性心血管问题或被视为复杂病例时,再次启动 MDT,讨论并落实后续管理方案。
4.4 深静脉血栓共病诊治原则
肿瘤患者本身就处于高凝状态,而多种抗癌治疗(如化疗、抗血管生成药物、免疫治疗)可进一步增加静脉血栓栓塞(Venous thromboembolism, VTE)和动脉血栓栓塞(Arterial thromboembolism, ATE)的风险。VTE包括深静脉血栓(Deep venous thrombosis, DVT)和肺栓塞(Pulmonary embolism, PE),是肿瘤患者常见的并发症和死亡原因[77-78]。 静脉血栓栓塞症是血液在静脉系统内异常凝结,阻塞血管而引起的一系列病症。VTE是肿瘤较常见的并发症之一,是仅次于肿瘤本身的第二大死亡原因。VTE发生率因原发肿瘤部位、肿瘤分期、病理类型、分子特征[79]等不同而异。在不同肿瘤类型中,VTE发生率为4%~20%,高发肿瘤类型为胰腺癌、肺癌、胃肠道肿瘤、卵巢癌。如果考虑无症状、尚未被发现的血栓形成,其发生率远高于此。肿瘤患者较非肿瘤患者VTE风险升高4~8.5倍[80-81]。首次发生VTE的病例中20%~30%与肿瘤相关,其中接受化疗的患者约占13%;妇科恶性肿瘤患者手术后VTE发病率为2.90%~19.87%,较妇科良性疾病患者高14倍。对于初次诊断的活动期肿瘤患者,VTE发生风险要高于其他时期。多数肿瘤患者在最初的3个月内发生VTE事件,6个月时达到累积发生率的高峰[82-83]。 血栓形成的病理生理机制传统上可通过Virchow三联征解释:静脉淤滞、血管壁损伤或功能障碍以及高凝状态。肿瘤患者通常存在多种与Virchow三联征相关的因素,使VTE更易高发。肿瘤相关VTE的危险因素包括患者本身因素、肿瘤相关因素和治疗相关因素三个方面。患者相关因素包括高龄、卧床、既往VTE病史、感染、吸烟、肝肾功能不全等。肿瘤相关因素包括肿瘤引起血液淤滞、血液高凝等。治疗相关因素包括手术、化疗、靶向治疗、免疫治疗、抗肿瘤支持治疗(如应用人促红细胞生成素)[84-85]和中心静脉血管通路植入等。一方面,肿瘤相关VTE的形成是多种因素共同作用的复杂过程,诱发VTE的因素和肿瘤的发生发展与治疗全程密切相关,需综合评估患者本身因素和肿瘤及其治疗相关因素;另一方面,VTE的发生严重恶化肿瘤患者预后,使患者生存期显著缩短、生命质量严重下降,并且加重医疗负担。建议对高危肿瘤患者早期开展VTE风险评估与预防性干预。
临床问题19:重视肿瘤患者中VTE高发情况,认识肿瘤与VTE之间的双向影响 专家共识19:肿瘤相关静脉血栓栓塞症(VTE)是恶性肿瘤常见的高危并发症,是肿瘤患者死亡的重要原因。其发生风险与原发肿瘤类型(如胰腺癌、肺癌、胃肠道肿瘤、卵巢癌等高发)、分期、病理类型及分子特征密切相关。VTE风险在肿瘤活动期、抗肿瘤治疗期间均不容忽视,强调重视肿瘤患者的全病程VTE防治工作。
4.4.2 VTE的诊断及鉴别
肿瘤患者常因免疫功能低下、治疗相关损伤或者肿瘤本身的侵袭转移而易合并VTE。由于其症状跟肿瘤本身症状重叠,易导致误诊或者延误诊断。因此需结合病史、影像学及实验室检查精准鉴别。 对肿瘤患者,要重点询问VTE病史、心脏病、慢性肾脏病、糖尿病、急性感染、吸烟等,是否有中心静脉血管通路,是否有手术史,是否有单侧的肢体肿胀、疼痛、沉重感,面部、颈部或者锁骨上区肿胀。 行肢体症状区域的多普勒超声检查(首选),优选加压血管超声检查,其灵敏度、准确性较高。可以选择CT静脉成像(仅对特定的患者,如肥胖、怀疑下腔静脉-脐静脉段DVT或盆腔肿物时选择)、静脉造影(有创性检查,应用有限)。 实验室检查:血常规、凝血功能、肝肾功能、D-二聚体、FDP、超敏C反应蛋白、血气分析[86]。 大部分的PE同时合并DVT,除了DVT症状,要重点询问不能以肿瘤解释的不明原因的气促、胸痛、心动过速、情绪不安,晕厥,外周血氧饱和度下降。 影像学检查:CT肺动脉造影(首选)、心电图、超声心动图,可以选择核素肺通气/灌注,肺动脉造影(有创性检查,应用有限)。 实验室检查:血常规、凝血功能、肝肾功能、D-二聚体、FDP、超敏C反应蛋白、血气分析;遗传性易栓症相关基因[86]。 Khorana风险评估表:用于评估肿瘤患者发生静脉血栓栓塞的风险,特别是在肿瘤治疗过程中。风险因素总分0分为低危,1~2分为中危,≥3分为高危。Khorana量表具体内容见表11。
| |
|
|
| |
| |
| |
血红蛋白水平<100 g/L,或在使用促红
细胞生成因子 | |
| |
| |
Caprini风险评估量表:适用于外科手术患者。入院2 h内完成评估,如遇急症手术等特殊情况,术后返回后完成评估,遇抢救等情况可延长至6 h内完成评估。低危患者每周评估1次,中危患者每周至少评估2次,高危及以上患者每日评估1次。风险因素总分 0~1分为低危,2分为中危,3~4分为高危,≥5分为极高危。Caprini量表具体内容见表12。
其他可选用量表:中国多发性骨髓瘤(Multiple myeloma, MM)患者VTE风险评估量表适用于中国MM患者[86];Padua风险评估表在内科住院患者中有较好的VTE预测价值[86]。
临床问题20:为肿瘤患者建立系统性VTE监测体系,在诊疗全过程中强化鉴别诊断,尽早识别VTE发生风险 专家共识20:应对所有肿瘤建立贯穿治疗全过程的VTE监测体系。通过病史、影像学、实验室检查鉴别诊断DVT以及PE,推荐检查手段见表13。管理肿瘤患者过程中可灵活运用多种VTE风险量表:Khorana风险评估表用于评估肿瘤患者治疗过程中发生VTE的风险;Caprini风险评估量表适用于外科手术患者;另外可选择针对中国MM患者的VTE风险评估量表或适用于内科住院患者的Padua风险评估表,为患者建立个体化VTE风险评估。 推荐强度:强推荐;专家共识度:87.5%。
| |
影像学检查:
• 首选肢体症状区域的多普勒超声检查,如加压血管超声(优选)
实验室检查:
• 血常规、凝血功能、肝肾功能
• D-二聚体、FDP
• 超敏C反应蛋白、血气分析 | 影像学检查:
• CT肺动脉造影(首选)
• 心电图
• 超声心动图
实验室检查:
• 血常规、凝血功能、肝肾功能
• D-二聚体、FDP
• 超敏C反应蛋白、血气分析 |
影像学检查:
• CT静脉成像
(仅适用于:肥胖、怀疑下腔静脉-脐静脉段DVT或盆腔肿物) | 影像学检查:
• 核素肺通气/灌注显像(V/Q显像) |
| 影像学检查:
• 肺动脉造影(有创性检查)
实验室检查:
• 遗传性易栓症相关基因检测 |
4.4.3 肿瘤合并VTE的诊治原则
无论预防还是治疗阶段,考虑抗凝治疗前均应排除抗凝治疗禁忌证[86]。 对于外科大手术患者,先用Caprini量表评估,对于中高危的患者,建议癌症手术患者在术前2~12小时用低分子肝素(LMFH)或者普通肝素(UFH),术后接受7~10天的血栓药物预防[87]。接受重大剖腹或经腹腔镜腹、盆腔手术的恶性肿瘤患者,如伴有行动不便、肥胖、VTE病史或者其他高危因素,建议将术后药物预防延长至4周[88]。延长的预防药物可以选择LMFH或者UFH,后桥接新型口服抗凝药(如利伐沙班、阿哌沙班、艾多沙班)。盆腔恶性肿瘤患者(卵巢癌、子宫内膜癌、宫颈癌和阴道癌)可以选择新型口服抗凝药。对于低危的患者,采用基础预防+机械预防。对于极低危者,采用基础预防。 不建议所有接受内科治疗的肿瘤患者进行常规药物预防抗凝治疗。对血栓风险高的肿瘤患者(如Khorana评分≥2分),除外出血和药物相互作用,在系统抗肿瘤治疗前,可以给予新型口服抗凝药或LMWH预防抗凝治疗,至少6个月。对于接受内科治疗,伴有急性疾病或者活动能力下降的患者,可用UFH、LMWH或者磺达肝癸钠。 肿瘤患者一旦发生VTE,包括深静脉血栓DVT或肺栓塞PE,应接受至少6个月的长期抗凝治疗,对于DVT,抗凝药物可以选择LMWH、新型口服抗凝药或华法林,研究显示LMWH优于华法林;PE抗凝药物可选择UFH、LMWH、磺达肝癸钠、新型口服抗凝药[86]。同时,在制定合并VTE肿瘤患者的化疗、靶向或免疫治疗方案时,需综合考虑以下因素: • 通常无需减量或更换方案:化疗、靶向或免疫治疗本身并不因VTE而常规减量、停止或更换。抗肿瘤治疗的决策应依据肿瘤本身的治疗反应、毒性反应及患者整体状况,而非单纯因VTE事件。 • 特殊药物需调整:部分抗肿瘤药物(如抗血管生成靶向药物、免疫调节药物如沙利度胺/来那度胺)与VTE风险显著相关,需评估是否需减量或暂停。 • 临床上广泛使用的抗肿瘤药物包括化疗药物、靶向药物以及相关支持类药物,其中大多数药物通过CYP3A3 或(和)P-gp 通道转运、代谢,可显著改变新型口服抗凝药血浆浓度,不应常规剂量同时使用[89]。 • 抗凝治疗优先:VTE确诊后,需立即启动抗凝治疗(首选低分子肝素LMWH,疗程至少3~6个月),而非优先调整抗肿瘤方案。 • 监测出血风险:若患者血小板<50×109/L,需权衡抗凝与出血风险,必要时暂停或减量抗凝药物。 • 持续评估:若肿瘤处于活动期(转移或持续治疗中),抗凝治疗需延长至6个月以上,甚至无限期。对低出血风险者可考虑无限期抗凝,但应定期评估抗凝治疗的风险/获益情况,确保有利的平衡。 • 对于出血风险较高类型肿瘤的患者,推荐应用 LMWH。出血风险较高的肿瘤患者包括原发灶未切除的胃肠肿瘤患者,泌尿生殖道、膀胱和肾盂及输尿管高出血风险肿瘤患者,活动性胃肠道黏膜异常(如十二指肠溃疡、胃炎、食管炎或结肠炎)患者。在特殊人群如肾功能不全、肥胖、血小板计数减少患者中,抗凝药物的选择及剂量应慎重考虑,临床上需充分权衡抗凝获益与出血风险后进行选择。 • 抗肿瘤方案的调整需基于肿瘤疗效和患者耐受性,而非VTE事件本身[90-91]。
临床问题21:对合并VTE的肿瘤患者进行个体化的治疗策略调整与剂量优化 专家共识21:对肿瘤与VTE共病患者的管理需遵循系统的治疗优化原则。 在排除抗凝治疗禁忌证的前提下,参考表14内容进行个体化预防性抗凝或抗凝治疗。 推荐强度:弱推荐;专家共识度:79.2%。
| | |
| | 术前2~12小时用LMFH或UFH,术后接受7~10天的血栓药物预防;
伴高危因素,建议将术后药物预防延长至4周 |
| 延长的预防药物可选LMFH或者UFH,后桥接新型口服抗凝药 |
|
| |
| |
| |
|
| | LMWH、新型口服抗凝药或华法林(LMWH优于华法林) |
| |
4.4.4 肿瘤合并VTE管理与MDT启动时机
肿瘤患者VTE诊疗管理需贯穿全程,主要步骤包括风险评估、动态监测、规范抗凝以及多学科协作。核心目标是降低VTE复发与出血风险,同时确保抗肿瘤治疗的连续性。各管理阶段的操作要点,见表15。
| | |
| | •采用Khorana评分(化疗前)
• 骨髓瘤患者采用中国VTE风险分层系统 |
| | • 下肢肿痛、呼吸困难、胸痛
• D-二聚体(特异性低,仅辅助) |
| | • DVT:下肢静脉超声(首选)
• PE:CT肺动脉造影(CTPA)或V/Q扫描 |
| • 无抗凝禁忌:立即抗凝
• 有抗凝禁忌:放置下腔静脉滤器 | • 一线抗凝:低分子肝素(LMWH)
• 口服抗凝:新型口服抗凝药(尤其非胃肠道肿瘤) |
| | • 抗凝疗程:活动期肿瘤≥6个月或长期
• 每3个月评估出血与复发风险 |
对肿瘤与VTE共病患者需实施基于MDT的全周期管理。通过对风险评估、动态监测、规范抗凝的三者流程把控,降低VTE复发与出血风险,同时确保抗肿瘤治疗的连续性。目前国内医院操作惯例为:(1)24小时内:符合表16中“立即启动”条件的病例,由主管医师发起,24小时内组织MDT。目前多家三甲医院已将此写入VTE快速反应流程。(2)72小时内:符合表14中择期场景,由科室秘书协调,72小时内完成MDT讨论。
表 16 肿瘤合并VTE的MDT启动时机
| | | |
| | 1. 肺栓塞伴血流动力学不稳定(高危PE)
2. 上肢/内脏/颅内静脉血栓
3. 需溶栓、介入或手术取栓 | |
| 4. 血小板<50×109/L
5. 活动性消化道出血
6. 脑转移伴出血倾向
7. 需要评估是否放置下腔静脉滤器
8. 评估减量抗凝 | 血液科
肿瘤内科
介入放射科
神经外科(如脑转移或脑出血) |
| 9. 正在使用高VTE风险药物
(如抗血管生成药、免疫调节剂)
10. 需要权衡停药/换药/剂量调整 | |
| | 11. 规范抗凝下VTE复发
12. 需要排除肿瘤进展、抗凝药物抵抗
13. D-二聚体持续升高 | |
| 14. 肿瘤已缓解/停药,需决定是否停用抗凝
15. 需要综合评估复发风险 vs. 出血风险 | |
4.5 泌尿系统常见共病诊治原则
泌尿系统常见共病包括肾脏疾病、排尿功能障碍、泌尿系感染。肿瘤相关性肾病的定义是肿瘤本身或肿瘤治疗过程中导致的肾脏损伤,临床上以急性肾损伤(Acute kidney injury, AKI)、慢性肾脏病(Chronic kidney disease, CKD)等常见。肿瘤患者中肾脏疾病的发病率显著高于普通人群,危重恶性肿瘤中AKI发生率可达52%[92]。肾损伤与肿瘤治疗相互影响,并影响患者的预后。肿瘤患者并发的肾脏疾病谱广泛,主要包括以下几种。 (1)肾小球疾病(Glomerular diseases):是以肾小球损伤和病变为主的一组疾病。肿瘤患者中的肾小球疾病可由肿瘤本身累及肾脏、造成膜性肾病(Membranous nephropathy, MN)导致,表现为蛋白尿、血尿甚至肾病综合征。MN是典型的癌症相关性肾小球肾炎,约10%的MN患者在诊断后1年内发现恶性肿瘤[93]。对于老年患者肾病综合征,应注意排查恶性肿瘤。肿瘤导致的肾病综合征可以随抗肿瘤治疗有效而得到缓解[94]。 (2)肾小管间质性疾病:是一组由于肾小管和周围间质发生炎症、损伤或纤维化而导致的疾病,包括急慢性间质性肾炎等。抗肿瘤药物可导致肾小管间质疾病易发,12%的抗肿瘤治疗患者出现肾小管间质性肾炎[95]。急性间质性肾炎是抗肿瘤药物导致AKI的常见原因[96-97],多由药物过敏等因素引发,若肿瘤患者在治疗中使用相关致敏药物,可能会加重病情,影响肿瘤治疗的顺利进行[98]。慢性间质性肾炎病程较长,可逐渐导致肾功能减退,使肿瘤患者对治疗的耐受性降低,增加治疗风险。 (3)慢性肾脏病:多种泌尿系统肿瘤(如肾癌、膀胱癌)可能会合并慢性肾脏病,其他系统恶性肿瘤,如结直肠癌、前列腺癌、宫颈癌等,也会累及泌尿系统,导致慢性肾脏病,或原有慢性肾脏病加重[99]。实体瘤患者中慢性肾脏病患病率较高,3期及以上的患病率范围为12%~25%[100-101]。高患病率尤其发生在老年患者或长期接受肾毒性药物治疗(如顺铂、甲氨蝶呤等)的群体。 (4)排尿功能障碍:肿瘤患者排尿功能障碍(Urinary dysfunction)可由肿瘤本身(如压迫、侵犯尿路系统)或其治疗(如手术、放疗、化疗)引起,表现为尿失禁、尿潴留、尿频、尿急等下尿路症状(Lower urinary tract symptoms, LUTS)。良性疾病如输尿管结石、良性前列腺增生(Benign prostate hyperplasia, BPH)均可能导致泌尿系梗阻。老年男性肿瘤患者常合并BPH,可能因激素治疗加重症状,导致严重LUTS[102]。肿瘤累及或压迫亦可导致泌尿系梗阻,常见于盆腔肿瘤(如前列腺癌、宫颈癌、膀胱癌)或腹膜后淋巴结转移压迫输尿管,表现为输尿管狭窄、肾积水等[103]。 (5)尿路感染(Urinary tract infection, UTI):常出现在免疫力低下、留置导管或存在泌尿系梗阻的患者中[104-105]。UTI可导致脓毒症、急性肾损伤等严重并发症,延长住院时间,最终对肿瘤治疗产生不利影响[105]。
临床问题22:重视肿瘤患者肾脏与泌尿系统共病高发率与不良影响 专家共识22:肿瘤患者是肾脏与泌尿系统疾病的高危人群,其高发病率与年龄、肿瘤类型和分期、肿瘤本身累及以及抗肿瘤治疗方式有关。肾脏与泌尿系统共病的发生发展也会影响抗肿瘤治疗的安全性与连续性。临床中需高度重视长期抗肿瘤治疗患者的肾脏与泌尿系统共病风险。 推荐强度:强推荐;专家共识度:87.5%。
肿瘤患者若存在泌尿系统共病,可通过免疫调节与肿瘤产生相互影响。慢性肾衰患者体内代谢产物蓄积,可导致氧化应激反应增强,损伤细胞 DNA,增加肿瘤发生的风险。同时,慢性肾衰引起的贫血、营养不良等情况,会削弱机体的免疫功能,使机体对肿瘤细胞的监视和清除能力下降,有利于肿瘤的生长和转移。肿瘤也会抑制机体的免疫应答,两者相互作用,使机体的免疫状态进一步恶化,不利于疾病的控制。肾功能不全会限制肾毒性化疗药物(如顺铂)的使用,一项针对19种成人肿瘤的大规模研究显示,终末期肾病与患者接受化疗和手术的概率降低显著相关[106];肾功能的损害可能会影响化疗药物等的排泄,增加药物不良反应的发生风险,多种细胞毒药物均需进行剂量调整。 肿瘤本身可通过转移侵犯泌尿系统器官,加重共病的病情。例如,膀胱癌可直接侵犯输尿管,导致尿路梗阻加重;前列腺癌骨转移可能压迫输尿管,引发肾积水等。另一方面,治疗肿瘤的药物也可导致多种肾病。某些化疗药物具有肾毒性(如顺铂、甲氨蝶呤、异环磷酰胺、链脲霉素等),可导致肾小管损伤,引发急性肾损伤或慢性肾衰[107-108];盆腔放疗可能损伤膀胱和输尿管黏膜,引起放射性膀胱炎、输尿管狭窄等。
肿瘤确诊后立即进行泌尿系统相关检查(尿常规、肾功能、泌尿系统超声等),明确共病诊断与分级,制定个体化方案并动态监测尿液性状、尿路症状、尿常规、肾功能(计算eGFR)等,并且定期进行影像学检查。如果肾功能进行性恶化(如发生AKI)、尿蛋白显著增多、排尿梗阻、泌尿系感染加重等,影响肿瘤治疗的进行,应优先控制共病。 对于已存在泌尿系统症状的患者,如尿频、尿急、尿痛、腰痛、血尿等,应及时进行进一步检查。肿瘤转移至肾脏和泌尿系统结石均可引起腰痛、血尿,需要注意区分肿瘤本身引起的泌尿系统症状与泌尿系统共病本身导致的症状。化疗药物引起的肾损伤与慢性肾衰的急性加重,在临床表现上可能相似,通过详细询问用药史、检查药物浓度、观察停药后的病情变化等可进行区分,必要时进行肾穿刺活检。对于泌尿系梗阻的鉴别,可应用超声、CT尿路造影(CT urography, CTU)或MR尿路造影(MR urography, MRU)明确梗阻部位;通过鉴别腹膜后纤维化、结石或肿瘤压迫等,明确泌尿系梗阻的原因。进行尿流动力学检查评估膀胱功能,结合神经影像学,注意区分神经源性膀胱与梗阻性病因。
临床问题23:肿瘤患者需定期监测肾功能,并通过鉴别诊断尽早识别、处理泌尿系统病变 专家共识23:所有癌症患者,无论是否接受潜在肾毒性药物,都需要进行肾功能监测。另外,泌尿系统共病常需与肿瘤本身或化疗药物所致的泌尿系统症状进行鉴别诊断,如对于老年患者新发现的肾脏疾病,应注意排除肿瘤引起的继发性肾脏病可能[109]。肿瘤患者治疗过程中应注意对尿常规、肾功能等进行动态检测,及时发现并处理抗肿瘤治疗导致的肾脏及泌尿系统损伤。未被发现的肾脏清除率下降可能会显著增加治疗药物的暴露,从而可能降低治疗的安全性并加重肾功能损害[110]。
4.5.3 肿瘤合并泌尿系统共病的诊治原则
肾功能不全影响经肾脏排泄药物的代谢过程,增加骨髓抑制、神经毒性等风险[111]。对肿瘤治疗来说,梗阻性肾病可导致急性肾损伤(AKI),影响化疗耐受性[112];合并尿路感染可能加重化疗或免疫治疗的骨髓抑制及感染加重的风险。常见的肾毒性药物包括顺铂、环磷酰胺、异环磷酰胺、甲氨蝶呤、分子靶向药物等,其肾毒性表现各异,影响因素众多,预防和治疗方法也不尽相同(表17)。因此抗肿瘤治疗时需根据肾功能水平进行药物剂量调整,或更改抗肿瘤治疗方案。
表 17 肿瘤-泌尿系统共病患者的抗肿瘤治疗策略建议 | | | |
| | | |
| | CKD患者需注意累积剂量
ESRD患者需根据血液透析(HD)时间调整给药间隙 |
| | 肌酐清除率(Ccr)<60 ml/min时需减量或停药
在HD后减量50%给药,腹膜透析患者也建议减量50%
必须联用美司钠预防出血性膀胱炎 |
| | 轻度肾衰:无需调整;
中度肾衰:减量50%;
严重肾衰:避免使用 |
|
| |
|
| |
| | | |
| | | CKD患者可常规使用;终末期肾病(ESRD)患者通常无需调整剂量 |
| | | 根据CTCAE分级管理:
Ⅰ级(尿蛋白+):继续靶向药物治疗
Ⅱ级(尿蛋白++~+++):24 h尿蛋白<2 g/d可继续治疗;≥2 g/d则暂停,尿蛋白恢复后可复用
Ⅲ级(尿蛋白≥3.5 g/d):暂停治疗直至恢复;若出现肾病综合征则永久停药
轻至中度肾功能不全者通常无需调整剂量 |
临床问题24:肾功能不全或高风险患者的抗肿瘤药物应如何选择? 专家共识24:抗肿瘤药物应用的过程中,可能会对患者的肾脏造成损伤,给治疗带来挑战。抗肿瘤治疗前应充分了解常见药物的肾毒性特点及应对策略,从而提高治疗的安全性和有效性。 推荐强度:强推荐;专家共识度:100%。
4.5.4 肿瘤合并泌尿系统共病的管理与MDT启动时机肿瘤合并泌尿系统共病管理的MDT团队推荐由多个学科组成:肿瘤内科、泌尿外科、肾内科、放疗科、感染科、康复科、介入科。当出现肾功能急性恶化、严重蛋白尿、尿路梗阻或感染加重等情况,并已影响抗肿瘤治疗时,建议优先控制共病。 MDT启动指征为:(1)肿瘤与泌尿系统共病的诊断不明确;(2)肿瘤患者合并复杂泌尿系梗阻;(3)肿瘤患者合并严重肾功能衰竭,或既往抗肿瘤治疗曾导致急性肾功能损伤;(4)抗肿瘤治疗过程中出现严重的泌尿系统不良反应,如急性肾损伤、严重的放射性膀胱炎等。
4.6 内分泌系统常见共病诊治原则
甲状腺功能亢进症指由甲状腺组织产生和分泌过多甲状腺激素引起机体代谢亢进、多系统兴奋性增高的一组疾病。在甲状腺功能亢进患者手术中发现的甲状腺癌患病率差异显著,最高可达21.1%[113]。与肿瘤相关的病因包括毒性甲状腺腺瘤、功能性甲状腺癌转移、分泌促甲状腺激素(thyroid stimulating hormone, TSH)的垂体腺瘤以及肿瘤治疗介导的特殊类型甲亢。 甲状腺功能减退症是由于甲状腺激素合成分泌减少导致的全身代谢减低综合征。甲减与肝癌、乳腺癌、皮肤癌的发病风险增加相关[114-115]。研究发现甲减患者罹患癌症的概率比非甲减患者高出一倍多[116]。 尽管恶性肿瘤(肺癌、乳腺癌、胃癌等)的肾上腺转移并不少见,但由于肾上腺的代偿功能强,除了淋巴瘤外很少有其他肿瘤导致肾上腺功能减退。然而,肾上腺对肿瘤治疗药物极为敏感,容易受到药物毒性影响而造成肾上腺皮质功能减退[117]。 肿瘤相关糖尿病是指肿瘤患者合并已知的糖尿病、由肿瘤本身或肿瘤治疗所引发的糖尿病。约20%的癌症患者同时患有糖尿病[118],癌症患者新发糖尿病的风险也明显增加。糖尿病和恶性肿瘤之间存在共同的风险因素[119],两种疾病的共存会影响患者的生活质量和预期寿命[120]。糖尿病个体发生恶性肿瘤的风险增加,包括结直肠癌、肝癌、胰腺癌、乳腺癌和子宫内膜癌等[121-122]。2型糖尿病患者的癌症死亡率比普通人群高18%[123]。与非糖尿病患者相比,高血糖会影响肿瘤治疗方案的选择、削弱化疗效果、增加肿瘤治疗中感染和急诊入院率,与多种恶性肿瘤的不良预后密切相关[124-127]。
临床问题25:为什么需要关注肿瘤患者的内分泌功能异常? 专家共识25:甲状腺功能紊乱、糖尿病、肾上腺皮质功能减退是临床上常见的肿瘤共病:糖尿病及甲状腺功能紊乱患者的肿瘤发病风险显著增加,同时肿瘤治疗易引起肾上腺皮质功能减退及血糖紊乱。基于肿瘤与内分泌腺体的密切关系,应关注常见的内分泌功能紊乱肿瘤共病谱。 推荐强度:强推荐;专家共识度:87.5%。
内分泌系统共病与肿瘤之间存在潜在的相互影响机制。一方面,高血糖及分泌紊乱的甲状腺激素以及促甲状腺激素可能与恶性肿瘤的发生发展和不良预后相关;另一方面,内分泌腺体血供丰富,肿瘤治疗过程中易受多种抗肿瘤药物(尤其是免疫检查点抑制剂等药物)的影响,诱发内分泌功能紊乱或加剧原有的内分泌功能紊乱。肿瘤可通过破坏胰岛功能、分泌过量升糖激素等多种途径诱发糖尿病。抗肿瘤治疗及支持治疗药物(如地塞米松)可通过影响胰岛素信号通路、导致胰岛素抵抗而引发糖尿病或血糖紊乱。临床上,未得到有效控制的内分泌功能紊乱可导致肿瘤治疗终止或治疗模式转变。了解共病相互作用机制有助于指导临床实践中对风险的评估、并发症的预防和治疗策略的制定。
(1)甲状腺功能紊乱:当肿瘤患者出现代谢亢进(如心悸、出汗、手抖、消瘦等)或代谢减退(如浮肿、怕冷、萎靡、心动过缓等)的表现时,应高度怀疑甲状腺功能异常,及时进行甲状腺功能及自身抗体检测。针对甲状腺功能紊乱的患者,应详细询问甲状腺疾病史及肿瘤诊治史,关注特定肿瘤治疗如靶向治疗(如酪氨酸激酶抑制剂)和免疫检查点抑制剂等导致甲状腺功能损伤的可能性。 (2)肾上腺皮质功能减退:临床上需要关注肿瘤转移或特定肿瘤治疗导致肾上腺皮质功能减退的可能性。肾上腺皮质功能减退症临床表现包括:乏力、纳差、呕吐、低血压、低血糖和低钠血症。因早期症状与肿瘤部分表现类似,缺乏特异性而容易被忽视。诊断肾上腺皮质功能减退时需评价垂体-肾上腺轴的功能,测定血皮质醇昼夜节律和24小时尿游离皮质醇。 (3)糖尿病:肿瘤患者在以下情形应立即进行血糖筛查以建立基线水平:①新近出现多饮、多尿、体重下降或住院期间反复血糖偏高;②属于高风险肿瘤/治疗暴露(如胰腺肿瘤、神经内分泌肿瘤、嗜铬细胞瘤等;或正在接受可能致高糖的抗肿瘤治疗及激素辅助用药);③合并肝肾功能受损或推测胰岛β细胞损害者。首诊评估应包含病史与暴露、空腹血糖(FPG)、随机血糖、必要时进行口服葡萄糖耐量试验(OGTT)及检测糖化血红蛋白(HbA1c)。确诊糖尿病者需进一步评估血糖控制水平、急性并发症风险(高血糖急症或低血糖风险)及慢性并发症负担(如糖尿病肾病、视网膜病变和心血管疾病),建议纳入肾功能(eGFR)、尿蛋白、心电图、眼底筛查等作为共病严重程度的综合评估指标,以指导个体化抗肿瘤治疗方案的调整。 (4)鉴别诊断:甲状腺功能亢进症在诊断上需要与症状性甲亢相鉴别。症状性甲亢指甲状腺组织被破坏后,甲状腺激素释放入血而出现的一过性甲状腺毒症,可由特定的肿瘤治疗(靶向、免疫治疗)导致[128-129],实验室检查亦可呈现TSH减低、血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)水平升高,但随后发展为暂时性或永久性甲减。 甲状腺功能减退症患者中TSH水平可区分其病因源于垂体还是甲状腺。甲状腺彩超、促甲状腺素受体抗体(TRAb)、甲状腺核素扫描或摄碘率等有助于鉴别诊断。 促肾上腺皮质激素(ACTH)水平用于鉴别原发性或垂体性肾上腺皮质功能减退。定位诊断还可以选择垂体MR、肾上腺CT扫描。考虑垂体性肾上腺皮质功能不全时,还需筛查其他垂体及靶腺激素,包括甲状腺轴、性腺轴(FSH、LH、睾酮/雌二醇)、生长激素(GH/IGF-1)、泌乳素以及垂体后叶功能[130]。由于肿瘤治疗中可能存在长疗程和应用大剂量糖皮质激素,在评估肾上腺轴功能时应注意外源性糖皮质激素的干扰[131-132]。 糖尿病需要与应激性高血糖相鉴别:脑出血、手术、创伤、麻醉等应激状态可致一过性血糖升高,部分病例在随访中发现可归复或少量进展为糖尿病,需结合病程动态与HbA1c区分。 药物/合并症相关高血糖:除肿瘤与抗肿瘤治疗外,还应排查高糖饮食、药物性肝损伤或胰腺损伤、肝硬化/肝炎等;类固醇性高血糖/糖尿病常伴满月脸、向心性肥胖与高血压等体征,应纳入糖尿病的鉴别诊断并据此优化监测策略。
临床问题26:警惕肿瘤患者出现内分泌紊乱症状,通过鉴别诊断尽早识别病因 专家共识26:肿瘤患者内分泌功能紊乱的诊断主要依据详细询问病史、识别特定肿瘤治疗(化疗、靶向、免疫检查点抑制剂)对内分泌腺体的影响,同时结合临床表现、激素和抗体检测以及影像学检查,对内分泌功能进行系统而全面的动态评估,实现病因的定性及定位诊断。 推荐强度:强推荐;专家共识度:87.5%。
在抗肿瘤治疗过程中,应根据不同的甲亢病因调整抗甲亢治疗:①合并肿瘤的毒性弥漫性甲状腺肿(Graves病)患者,在接受长期抗甲亢药物(甲巯咪唑、丙硫氧嘧啶)治疗过程中,如果出现甲亢病情反复、肝功能损害、中性粒细胞减少等副作用干扰抗肿瘤治疗时,推荐选择131I治疗;②若甲亢的病因为毒性甲状腺腺瘤、功能性甲状腺癌、分泌TSH的垂体腺瘤,首选手术治疗;③对于一过性甲状腺毒症,尽量避免使用碘造影剂,可予β-受体阻滞剂控制心率,适当提高甲状腺功能监测频率直至出现甲减,随后转入甲减治疗阶段。 肿瘤治疗中未控制的甲状腺功能减退症常会导致手术治疗延迟,因此控制甲减对肿瘤治疗至关重要。绝大部分的甲状腺功能减退症患者需接受长期左甲状腺素(L-T4)替代治疗(推荐剂量为1.0~1.6 μg/kg/d),L-T4的起始剂量和达到完全替代剂量所需时间要根据年龄、体重和心脏功能状态确定[133]。治疗期间定期监测甲状腺功能以便调整药物剂量。垂体性甲减患者采用替代治疗前需评估肾上腺轴功能、避免加剧肾上腺功能不足[134],治疗期间应选择FT4而不是TSH作为监测指标。当治疗不达标时应及时确认患者的服药依从性及给药方式,推荐每日晨起空腹服药,与服用其他药物的间隔时间应当在4小时以上。 肿瘤患者在联合多种治疗药物、鼻饲饮食的过程中应注意药物的吸收问题。对于ICIs引起的甲状腺功能损害的肿瘤患者,在出现严重甲状腺功能紊乱时,应暂停ICIs类药物治疗至甲状腺功能恢复,若出现黏液水肿昏迷则需永久停用[135]。但也有国外学者认为ICIs可以推迟但不应中断,待甲状腺危象缓解后可恢复治疗[130,136]。 下丘脑-垂体-肾上腺轴的替代治疗首选氢化可的松(生理替代剂量为15~20 mg/d,分2~3次给药),目前尚缺乏可靠的生化指标以评估替代治疗剂量的适宜性。治疗期间建议监测临床症状以及血糖、血压、血钠水平以调整剂量。外源性糖皮质激素导致的继发性肾上腺皮质功能减退者,在肾上腺皮质功能恢复前也应接受生理剂量氢化可的松治疗。此类患者需接受相关应激处理教育,并佩戴医疗警示标志[137]。在患者合并感染、手术等急性应激时,需早期应用静脉大剂量糖皮质激素,防止发生垂体危象。 在制定肿瘤合并糖尿病患者治疗方案时,应综合评估患者的年龄、肿瘤分期、功能状态、低血糖风险、营养情况及预期寿命,明确个体化的血糖控制目标。对预后较好、治疗周期较长的患者:建议设定严格的血糖控制目标(HbA1c<7.0%,TIR≥70%)[138],以减少癌症治疗相关急性并发症并预防糖尿病的血管、神经并发症;针对预期寿命有限、低血糖高危或危重症患者,可适当放宽控制目标(如HbA1c 7.0~8.0%,随机血糖维持 7.8~10.0 mmol/L)[138],维持可接受的血糖水平,改善患者健康状况[139]。 临床需高度警惕DKA/HHS等急性并发症,并在免疫治疗中注意ICI诱导的糖尿病。口服药物选择应优先考虑二甲双胍,谨慎使用低血糖风险较高或存在肝肾功能限制的药物,并可根据具体情况选择GLP-1受体激动剂、DPP-4或SGLT2抑制剂。抗肿瘤治疗(包括化疗/靶向药物、免疫治疗及围手术期)过程中,应密切监测血糖,必要时调整胰岛素剂量,以实现个体化管理和风险分层。
专家共识27:合并肿瘤的甲状腺功能亢进症者应根据病因调整相应的治疗方案。合并肿瘤的内分泌功能减退症患者大部分需接受长期激素替代治疗。左甲状腺素(L-T4)是甲状腺功能减退症的主要替代治疗药物,治疗期间定期监测甲状腺功能以便及时调整剂量。垂体性甲减患者替代治疗前需评估肾上腺轴功能、选择FT4作为监测指标。肾上腺皮质功能减退的替代治疗首选氢化可的松。出现因肿瘤治疗导致的内分泌功能危象,应暂停原方案至内分泌功能恢复。肿瘤合并糖尿病患者在制定治疗方案时,应综合评估患者的年龄、肿瘤分期、功能状态、低血糖风险、营养情况及预期寿命,明确个体化的血糖控制目标。
4.6.4 肿瘤合并内分泌系统共病的管理与MDT启动时机
在制定肿瘤诊治方案前,应对患者是否合并内分泌系统共病进行筛查,评估内分泌系统不良反应的风险,早期识别高危患者。接受ICIs治疗过程中应进行全程管理,关注内分泌激素紊乱引起的临床症状,密切监测内分泌功能和生化指标,尽早发现内分泌损伤并及时进行替代治疗,避免严重内分泌危象。随访期间需加强患者自身管理、定期咨询内分泌专科医师、完善内分泌随访体系,使患者最大程度获益。 肿瘤共病的内分泌功能紊乱的管理,强调多学科协作、早期识别、个体化干预与全流程管理。其MDT团队推荐由多个学科组成:肿瘤科、内分泌科、外科、影像科、核医学科等。 紧急MDT适用于危及生命的急性事件,强调快速响应;择期MDT侧重于复杂病例的全面规划和长期管理,需在关键决策点(如治疗前、方案调整、随访异常)启动。实际启动时机需结合医院资源配置和患者具体病情,作出个体化决策。MDT启动条件,见表18。
表 18 肿瘤合并内分泌系统共病管理的MDT启动条件 | | | |
| | 1. 抗肿瘤过程中出现高血糖危象(如糖尿病酮症酸中毒)、
甲状腺危象、垂体瘤卒中或肾上腺皮质功能不全等内分泌相关急症;
2. 围术期内分泌紊乱(如电解质失衡、血糖失控)影响手术安全时;
3. 高血糖等内分泌紊乱合并严重感染或器官衰竭 | |
| | 4. 初诊复杂病例;
5. 更换治疗方案前评估内分泌共病稳定性和风险;
6. 长期激素治疗(如乳腺癌内分泌治疗)协调代谢管理;
(如骨健康、血糖监测);
7. 康复与随访协调 | |
4.7 神经系统常见共病诊治原则
脑血管疾病是因脑部血管循环障碍引起的脑组织缺血或出血性病变,包括缺血性脑血管病(如脑梗死)和出血性脑血管病(如脑出血、蛛网膜下腔出血)。肿瘤患者脑血管疾病发病风险更高,肿瘤本身、相关治疗及并发症都会升高脑血管事件发生风险,其中脑梗死在晚期肿瘤患者中发生率可达10%~20%[140]。 神经变性疾病是一组以中枢神经系统神经元进行性变性、死亡为核心特征的慢性疾病。常见类型包括:阿尔茨海默病(AD)、帕金森病(PD)、肌萎缩侧索硬化(ALS)等[141]。肿瘤患者以老年人居多,因此神经功能衰退(如认知障碍、运动迟缓)风险显著上升。一项针对正在接受癌症护理的老年人的横断面研究显示,63%患者同时患有一定程度的神经认知功能障碍[142]。 癫痫是一组由多种病因引起的慢性脑部疾病,以大脑神经元过度同步放电导致反复性、发作性和短暂性的中枢神经系统功能失常为特征。脑肿瘤是成人症状性癫痫的常见原因,25%~60%的脑肿瘤患者会出现癫痫发作,肿瘤通过直接压迫脑组织、引发局部炎性反应、破坏神经递质平衡等机制诱发癫痫,且肿瘤位于大脑皮质(如颞叶、额叶)时更易导致发作[143]。 自身免疫性脑病是一类由机体免疫系统异常激活,产生针对中枢神经系统抗原的自身抗体,从而导致脑功能障碍的疾病,其病因尚未完全明确,但有相当一部分研究认为其可能与肿瘤相关,如抗 N-甲基-D-天冬氨酸受体脑炎常与卵巢畸胎瘤相伴发。 恶性肿瘤合并神经系统原发肿瘤也是共病之一,其发生率大约为2%~8%。脑膜瘤、神经鞘瘤、垂体瘤等是颅内常见原发性良性肿瘤,生长缓慢,早期无症状,生长到一定大小后可引起相应症状。胶质瘤、中枢神经系统原发性淋巴瘤是神经系统最常见的原发肿瘤,进展较快,预后较差[144]。 化疗诱导性周围神经病变(CIPN):化疗诱导性周围神经病变是肿瘤化疗中最常见的神经毒性之一,有研究报告称 CIPN 的总患病率为 48%[145]。CIPN可表现为神经病理性疼痛,主要由铂类(顺铂、奥沙利铂)、紫杉类(紫杉醇、多西他赛)、长春碱类(长春新碱)等药物损伤外周神经所致,其典型表现为肢体远端对称性感觉异常,如麻木、刺痛、烧灼感,严重时可出现运动功能障碍(如足下垂、手部精细动作困难),甚至影响行走和日常活动[146]。 放疗相关神经病变:放疗相关神经病变由放射线直接损伤外周神经或通过血管损伤、组织纤维化间接压迫神经引起,多见于头颈部、盆腔、纵隔等部位的放疗后,常见受累神经包括臂丛神经(如乳腺癌)、腰骶丛神经(如前列腺癌、直肠癌)及颅神经(如鼻咽癌),表现为神经分布区域的疼痛(如肩臂部放射性疼痛)、感觉减退、肌肉萎缩,症状多在放疗后数周至数月缓慢出现,且可能进行性加重[147-148]。 免疫检查点抑制剂相关神经毒性:免疫检查点抑制剂(如抗PD-1/PD-L1抗体)通过激活免疫系统发挥抗肿瘤作用,但可能诱发自身免疫性神经损伤,其中吉兰-巴雷综合征(GBS)是较严重的类型之一,尽管其发病率低于1%[149]。 副肿瘤性周围神经病是由肿瘤诱发的自身免疫反应累及外周神经而导致的疾病,属于副肿瘤综合征的一种,其发病机制为肿瘤细胞表达与外周神经组织相似的抗原,引发机体免疫系统产生自身抗体,这些抗体错误地攻击外周神经,导致神经损伤[150]。该病多见于小细胞肺癌、淋巴瘤、乳腺癌、卵巢癌和浆细胞病等恶性肿瘤,可在肿瘤确诊前、同时或确诊后出现[151]。 代谢性外周神经病变多是由机体代谢异常引发的外周神经损害。肿瘤患者常见诱因包括营养不良(如维生素D缺乏)、肿瘤相关高血糖或糖尿病、肝肾功能不全导致的毒素蓄积等[152-153]。感染性外周神经病变则由病原体直接侵犯外周神经所致,肿瘤患者因化疗等抗肿瘤治疗导致白细胞减少、免疫力低下,更易发生感染,从而增加感染性外周神经病变的可能[154]。此外,带状疱疹等感染性外周神经系统疾病也会显著增加,据报道,相较于正常人,血液系统恶性肿瘤患者带状疱疹的年龄和性别标准化发病率高出4.8倍,实体瘤患者高出1.9倍[155]。
临床问题28:关注肿瘤患者中枢及外周神经系统共病高发率带来管理难度 专家共识28:神经系统疾病在肿瘤患者中常作为重要共病并存。其高发疾病谱主要包括:1.中枢系统疾病,如脑血管病、神经变性疾病、癫痫、自身免疫性脑病、颅内转移或原发肿瘤;2.外周系统疾病,如肿瘤治疗(化疗、放疗、免疫治疗)相关神经病变、副肿瘤性周围神经病以及代谢性或感染性神经病变。肿瘤伴随中枢及外周神经系统共病时会显著增加临床管理难度,影响患者的预后和生活质量,并且加重患者经济负担。 推荐强度:强推荐;专家共识度:91.7%。
神经系统共病与肿瘤之间存在重要的相互影响机制。一方面,肿瘤的存在会诱发或加重各种中枢和外周神经系统疾病;另一方面,外周神经病变以及自身免疫性脑炎的治疗方式被认为会削弱机体的肿瘤免疫监视、促进肿瘤发展进程。了解神经系统共病与肿瘤之间的具体作用机制,有助于指导临床实践中治疗策略的制定。
4.7.2 神经系统共病的诊断及鉴别
肿瘤患者可伴发多种神经系统共病,必须通过鉴别诊断尽早识别疾病种类和病因。肿瘤患者的神经系统共病诊断核心为:结合肿瘤背景、治疗史及多维检查(影像/电生理/抗体/生物标志物/脑脊液等),实现早辨早治。各类神经系统共病有其各自的诊断和鉴别要点:(1)脑血管病:依据急性起病+典型影像(DWI高信号/CT高密度影),区别于肿瘤转移/放疗损伤/癌性脑膜炎;(2)神经变性疾病:依据慢性进行性病程+特异性核心症状+生物标志物(如Aβ42/tau),区别于化疗认知损伤/代谢性脑病;(3)癫痫:通过脑电图痫样放电+肿瘤/治疗诱因分析,区别于肿瘤直接侵犯;(4)自身免疫性脑病:关键在特异性自身抗体(如抗 NMDAR 抗体、抗 Hu 抗体)检测及边缘系统影像特征,区别于肿瘤转移/代谢病因;(5)合并颅内肿瘤:明确肿瘤类型的病理活检是金标准,可从影像学特征鉴别转移瘤或原发瘤;(6)治疗相关神经毒性:依据肿瘤治疗时序+神经电生理特征,区别于肿瘤转移、复发、进展、压迫所致;(7)副肿瘤性神经病:与肿瘤发展时序关联,强调抗体筛查(如抗Hu、抗 CV2 抗体);(8)代谢/感染性神经病变:需排查肿瘤患者营养缺乏/感染病原等可逆因素。
4.7.3 肿瘤合并神经系统共病的诊治原则
4.7.3.1 基于神经病变严重程度的抗肿瘤治疗调整(1)化疗诱导性周围神经病变(CIPN)的剂量调整:根据CIPN程度调整。轻度(1 级:麻木/刺痛不影响日常活动):维持原剂量,联用神经保护剂(如谷胱甘肽、度洛西汀);中度(2 级:症状影响日常活动):化疗药物减量 25%~50%(如紫杉醇从 175 mg/m2 减至 135 mg/m2),延迟给药周期至症状缓解;重度(3~4 级:感觉丧失、运动无力或疼痛难以忍受):暂停化疗,换用非神经毒性药物(如卡培他滨替代奥沙利铂)。 (2)放疗相关神经病变的治疗调整:若放疗中出现急性神经痛(如臂丛神经受累),需暂停放疗并给予镇痛(如加巴喷丁),待症状缓解后缩小照射野或降低剂量(如从60 Gy降至50 Gy);慢性放疗损伤(如腰骶丛纤维化)以对症治疗为主,避免再次放疗同一区域,必要时手术松解神经压迫。 (3)免疫治疗相关神经毒性的停药与重启:根据神经毒性症状轻重进行分级管理。轻度(1 级:局限于感觉异常):继续免疫治疗,加用神经营养剂;中度(2 级:伴运动无力):暂停治疗,给予糖皮质激素(如甲泼尼龙 1 mg/(kg·d)),症状恢复至 1 级以下可重启并剂量减半;重度(3~4 级:如吉兰-巴雷综合征):永久停用免疫治疗,采用大剂量激素冲击或血浆置换。 (1)止痛与对症治疗的安全性优先:阿片类药物(如吗啡)虽能缓解神经痛,但可能加重肿瘤患者的便秘、呼吸抑制,尤其对于合并呼吸功能不全者优先选用非甾体抗炎药(如塞来昔布)或抗惊厥药(如美洛加巴林[34]、普瑞巴林);自主神经病变(如体位性低血压)选用米多君时,需监测肿瘤患者的心率和血压,避免与化疗药物(如长春新碱)联用导致心律失常。(2)神经营养与修复的协同用药:维生素 B 族(B1、B6、B12)可联合使用,但需避免与化疗药物(如甲氨蝶呤)在同一时间给药(间隔至少 2 小时),以防影响化疗药物吸收;维生素 B6需控制剂量,每日不超过 100 mg;对于代谢性神经病变(如维生素 B12 缺乏),优先采用肌内注射补充以避免口服吸收不良,待症状改善后改为口服维持。
临床问题29:平衡神经系统共病患者的治疗目标,对患者进行个体化的治疗策略调整与剂量优化 专家共识29:肿瘤合并神经系统共病的治疗需建立 “抗肿瘤-神经保护-对症支持” 的多目标平衡,具体管理策略见表19。通过药物相互作用筛查、动态评估神经毒性分级、个体化调整剂量与方案,最大限度降低治疗冲突,同时保障肿瘤控制与神经功能恢复。 推荐强度:弱推荐;专家共识度:78.3%。
表 19 “抗肿瘤-神经保护-对症支持” 多目标管理策略 | | |
| 根据神经病变的类型和严重程度,动态调整抗肿瘤方案(减量、暂停、替换或终止) | 化疗:1级CIPN维持原剂量,联用神经保护剂(如谷胱甘肽、度洛西汀);2级CIPN减量25%-50%,延迟给药周期至症状缓解;3~4级CIPN暂停,换用非神经毒性药物(如卡培他滨替代奥沙利铂)
放疗:急性神经痛暂停放疗并给予镇痛(如加巴喷丁),症状缓解后缩小照射野或降低剂量;慢性损伤以对症治疗为主,避免再照射同一区域,必要时手术松解神经压迫
免疫治疗:1级神经毒性,继续治疗并加用神经营养剂;
2级神经毒性暂停,给予糖皮质激素(如甲泼尼龙 1 mg·kg−1·d−1),待恢复至 1 级以下重启,并且剂量减半;
3~4级永久停药,采用大剂量激素冲击或血浆置换 |
| 管理药物相互作用,选用安全的神经营养/免疫调节剂,旨在修复神经损伤的同时,最大限度减少对抗肿瘤疗效的干扰或叠加毒性 | 避免代谢干扰:避免CYP3A4诱导剂(如抗癫痫药苯妥英钠、卡马西平)与紫杉类/铂类化疗药物联用
神经营养与修复:(1)避免高剂量B6(>100 mg/d)拮抗放疗;(2)维生素 B 族(B1、B6、B12)可联合使用,但需避免与化疗药物(如甲氨蝶呤)在同一时间给药(间隔至少 2 小时);(3)对于代谢性神经病变,优先采用肌内注射补充,待症状改善后改为口服维持
免疫调节:免疫性神经病需用糖皮质激素/免疫球蛋白,但可能削弱免疫治疗效果,需在控制神经毒性后评估是否重启免疫治疗
叠加作用:(1)警惕脑血管病的治疗药物(抗凝药、抗血小板药等)与抗肿瘤药物联用可能增加出血风险;
(2)警惕长春新碱与氨基糖苷类抗生素联用加重神经毒性 |
| | 止痛:合并呼吸功能不全者优选非甾体抗炎药(如塞来昔布)或抗惊厥药(如美洛加巴林、普瑞巴林);慎用阿片类药物(加重便秘/呼吸抑制)
其他对症治疗:自主神经病变(如体位性低血压)选用米多君时,需监测心率和血压,避免与化疗药物(如长春新碱)联用导致心律失常 |
4.7.4 肿瘤合并神经系统共病的管理与MDT启动时机
肿瘤合并神经系统共病的诊疗需遵循 “早期筛查-分层评估-多学科协作-动态调整” 原则,通过标准化流程实现肿瘤控制与神经功能保护的平衡。
5 肿瘤共病诊疗管理
应做到以下几点:(1)基础筛查:采集肿瘤病史(类型、分期、治疗史)、神经系统症状(如麻木、疼痛、无力、癫痫发作)及基础疾病(如糖尿病、高血压);(2)辅助检查,明确是否存在潜在神经共病:完善神经电生理(如肌电图、神经传导速度)、影像学(如头颅/脊髓 MRI)、实验室检查(如维生素水平、副肿瘤抗体、血糖);(3)风险分层:根据肿瘤治疗方案(如使用铂类、PD-1 抑制剂)和神经症状严重程度,划分低风险(无症状或轻度症状)、中风险(中度症状不影响治疗)、高风险(重度症状或危及生命)。对于不影响治疗的低、中风险患者,可维持原抗肿瘤治疗方案,过程中持续监测;而对于高风险患者,需明确病因后制定个体化治疗方案。
5.2 治疗实施阶段(抗肿瘤治疗中)
应做到以下几点:(1)同步监测:每 2~4 周评估神经症状变化(如麻木范围、疼痛评分、肌力分级),化疗患者需记录药物剂量与神经毒性相关性;(2)根据风险分层决定干预决策。低风险:维持原抗肿瘤方案,联用预防性神经保护剂(如甲钴胺、谷胱甘肽);中风险:调整抗肿瘤治疗(如化疗减量、放疗缩野),同时启动神经对症治疗(如美洛加巴林/普瑞巴林止痛、维生素补充);高风险:暂停抗肿瘤治疗,优先处理神经急症,如吉兰-巴雷综合征的血浆置换、癫痫持续状态的抗惊厥治疗。
5.3 在随访调整阶段(治疗后)
应做到以下几点:(1)长期监测:肿瘤缓解后每 3~6 个月复查神经功能,评估是否存在慢性神经损伤(如放疗后神经纤维化);(2)康复干预:针对残留神经功能障碍(如运动无力)制定康复计划(如物理治疗、职业训练),同时调整药物方案(如逐步减少止痛药物)。
5.4 MDT启动时机
在初始评估阶段,对于高风险患者需要尽早启动MDT评估,以明确病因。MDT团队应由肿瘤科和神经内科共同主导,联合神经外科、影像科、病理科、放疗科、药学部、康复科、疼痛科,必要时延伸至心理科、营养科。 在抗肿瘤治疗实施阶段,若评估发现神经症状加重,应紧急组织MDT讨论,高风险患者必要时转至神经科就诊。
结语
本共识基于当前国内外最新循证医学证据及我国临床实践现状,系统阐述了肿瘤共病的定义、分类、流行病学特征及其对肿瘤诊疗全过程的影响,并针对不同系统常见共病的评估、诊断、治疗及多学科协作管理提出了具体建议。共识强调,肿瘤共病管理应遵循“以患者为中心”的原则,建立贯穿肿瘤诊疗全程的系统性、个体化和多学科协作管理模式。通过早期识别共病风险、动态评估病情变化、优化治疗策略及加强长期随访,实现肿瘤治疗与共病管理的协同推进,最终达到改善患者生存预后、提升生活质量的核心目标。本共识旨在为临床医师提供全面而实用的诊疗参考,推动我国肿瘤共病管理的规范化与同质化,并为未来相关研究方向的拓展奠定基础。
主要执笔专家(按拼音排序)
所有作者共同参与共识撰写,并对最终版本进行了审阅与批准。编辑:Jack
相逢很短,关注很长