
中国医师协会肿瘤多学科诊疗专业委员会, 国家肿瘤质控中心肺癌质控专家委员会. 肺癌免疫检查点抑制剂联合放疗中国专家共识(2025版)[J]. 中华肿瘤杂志, 2025, 47(1): 39-64. DOI: 10.3760/cma.j.cn112152-20240929-00422.
肺癌在我国男性和女性恶性肿瘤中发病率和死亡率均位居首位。根据国家癌症中心发布的2022年中国恶性肿瘤流行情况分析,肺癌新发病例达106.06万例,死亡病例为73.33万例,肺癌给患者带来了沉重的治疗负担。随着以免疫治疗为代表的新治疗手段的出现,肺癌的治疗逐渐从以传统的手术、放疗和化疗为主,转变为传统治疗与免疫治疗等新增治疗手段结合的综合治疗。近年来,免疫检查点抑制剂与放疗的联合应用机制研究不断深入,临床证据也在快速积累,使这一领域成为临床关注的热点,但在治疗选择上仍存在诸多疑问,亟需规范化指导。为进一步推动我国免疫治疗与放疗联合使用的规范化,国家肿瘤质控中心肺癌质控专家委员会、中国医师协会肿瘤多学科诊疗专业委员会组织了多学科专家,针对免疫检查点抑制剂联合放疗在肺癌(包括非小细胞肺癌和小细胞肺癌)中的协同机制、应用模式及安全性等问题进行了深入探讨,形成了《肺癌免疫检查点抑制剂联合放疗中国专家共识(2025版)》。共识旨在为免疫治疗与放疗的联合使用提供指导,切实惠及肺癌患者。
【关键词】肺肿瘤;免疫检查点抑制剂;放疗;专家共识
肺癌是引起人类恶性肿瘤相关性死亡的首要原因,在中国男性和女性恶性肿瘤中均为发病率和死亡率最高的恶性肿瘤。根据国家癌症中心发布的2022年中国恶性肿瘤流行情况分析,肺癌的年发病例数高达106.06万例,死亡病例数则达到73.33万例,这不仅给患者及其家庭带来了心理和经济上的沉重负担,也对我国的医疗资源和卫生体系造成了巨大的压力。面对肺癌发病率的持续上升,亟需有效的治疗策略来改善患者的生存率和生活质量。
近年来,随着肿瘤免疫治疗的迅猛发展,免疫检查点抑制剂(immune checkpoint inhibitor, ICI)作为治疗肺癌的新型药物,正在显著改变肺癌的治疗格局。多项Ⅲ期研究显示,免疫治疗无论是在非小细胞肺癌(non-small cell lung cancer, NSCLC)还是在小细胞肺癌(small cell lung cancer, SCLC)的治疗中均展现出良好的疗效。放疗在肺癌的治疗中始终扮演着重要角色,不仅可以直接杀死肿瘤细胞,还能够引发机体的免疫反应。放疗能够增加肿瘤细胞的抗原释放,并改善肿瘤微环境,从而增强ICI的疗效。
虽然ICI与放疗的联合应用展现出良好的治疗潜力,但在实际操作中,临床医师面临着诸多疑惑和挑战,例如联合治疗的适用人群、联合治疗的最佳时机、剂量和方案的选择、接受放疗后免疫治疗启动时间及时长等。因此,迫切需要制定科学合理的指导原则,以规范化该联合治疗的应用。《肺癌免疫检查点抑制剂联合放疗中国专家共识(2025版)》(简称“共识”)旨在指导和推动免疫治疗与放疗联合使用的规范化,更好地惠及肺癌患者。
(一)共识发起的机构和专家组成员
本共识由国家癌症中心发起、联合中国医师协会肿瘤多学科诊疗专业委员会共同组织国内51名肿瘤内科、放疗科、呼吸科、胸外科多学科专家成立中国肺癌ICI联合放疗治疗专家组(以下简称专家组)牵头制定。
2024年5月18日启动,经过3轮会议讨论后,制定本专家共识。第1轮共识专家会议讨论共识框架和范围、证据及推荐级别;第2轮会议讨论确定临床问题,随后撰写初稿并针对推荐意见进行线上投票表决,并于2024年9月21日在第3轮会议对共识修改内容进行定稿。本共识专家组成员均已签署了书面利益冲突声明,不存在与本共识直接相关的利益冲突。
(二)证据检索
本专家共识依据具体临床问题进行研究对象-干预措施-对照措施-预期结果解构后设置关键检索词,进行系统的文献检索,检索数据库为PubMed及Embase,检索时限自2015年1月1日至2024年8月27日。并通过不同平台检索引擎的筛选功能,检索不同的研究类型文献。每个临床问题具有针对性的检索式,文献纳入类型包括随机对照试验、系统评价、荟萃分析、回顾性系统研究、临床病例系列研究、病例报告、指南和专家意见。通过阅读文献摘要筛选与具体临床问题有关的文献,将支持共识形成的重要文献证据整理到共识证据与考量部分。
(三)证据等级评定标准和推荐强度
共识推荐意见按意见类别和证据水平进行分别评估(表1)。先对证据类别及级别进行评估,然后结合本地医疗环境、医疗条件、经济成本、患者价值观综合考量确定推荐力度。
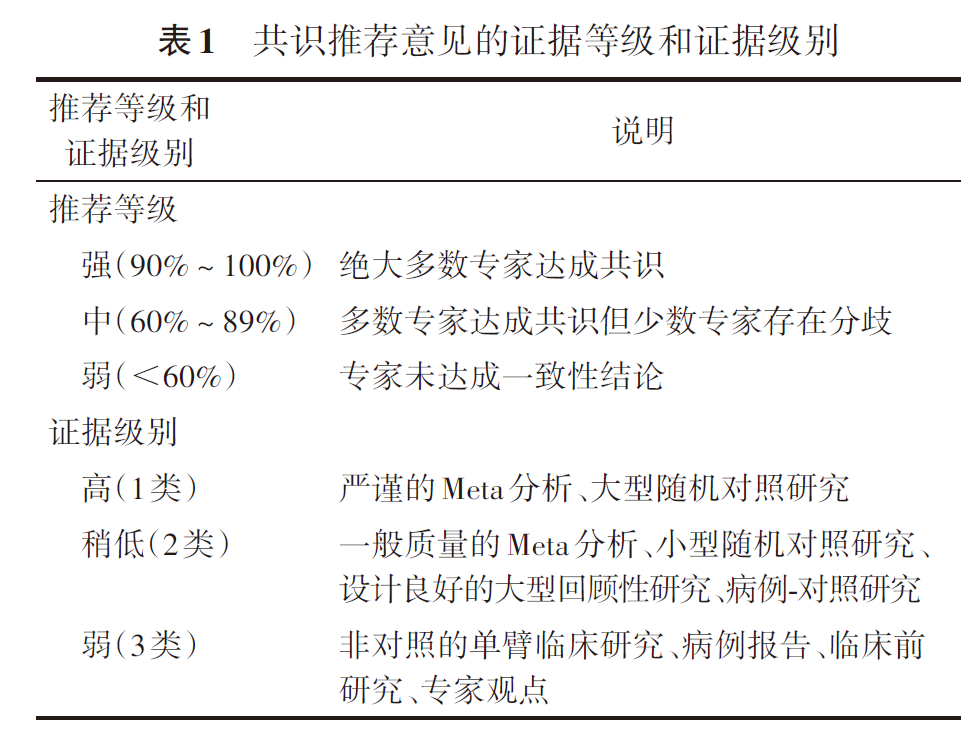
(四)推荐意见形成过程
1. 临床问题的确定:由执笔专家以临床实践治疗需求为基本遴选原则,初拟关键临床问题,专家组成员通过在线调研问卷及专家讨论会的形式提出修改建议,并最终经全体专家审阅确定26个临床问题。
2. 推荐意见形成:基于确定的临床问题,进行文献检索及梳理,确定纳入具体临床问题的临床证据,在对证据进行充分评价的基础上进行初稿撰写,通过专家组在线调研问卷及专家讨论会,形成推荐意见和推荐等级。
临床问题 1
放疗联合免疫治疗可以通过哪些病理生理和分子机制发挥协同治疗作用?
共识意见:放疗可以通过杀伤肿瘤细胞产生的原位疫苗效应、增强抗原提呈和树突状细胞(dendritic cell, DC)活化、重塑肿瘤免疫微环境以及调控免疫检查点分子表达的多种机制发挥与免疫治疗的协同作用(推荐等级:强,证据级别:3类证据)。
1. 放疗杀伤肿瘤细胞产生的原位疫苗效应:肿瘤细胞在受到照射后,在某些条件下可以发生免疫原性死亡,而这也是放疗所诱导的抗肿瘤免疫反应的始动环节。首先,放疗通过直接的电离辐射和间接的活性氧生成引起广泛的DNA损伤,DNA损伤能够作为肿瘤相关抗原的来源,为机体激活适应性免疫反应提供了基础。释放的肿瘤抗原可进一步被抗原提呈细胞所摄取和提呈,从而启动并激活辅助性T细胞(T helper cell, Th)和细胞毒性T淋巴细胞,最终形成T细胞介导的特异性免疫反应。
放疗导致的肿瘤细胞免疫原性死亡还可以通过释放损伤相关分子模式(damage-associated molecular pattern, DAMP)分子激活抗肿瘤免疫反应。这些DAMP分子可与DC和巨噬细胞表面的模式识别受体如Toll样受体、RIG-I样受体和NOD样受体等结合,激活下游相关信号通路来促进DC的成熟和巨噬细胞促炎因子的释放。相较于光子放疗,重离子治疗能够导致肿瘤细胞DNA产生以双链破坏为主的复杂性团簇损伤,积聚更多的胞质双链DNA,因此可以更加有效激活cGAS-STING通路诱导机体产生更强的免疫应答。
2. 放疗增强抗原提呈和DC活化:肿瘤抗原通过内源性或外源性抗原提呈途径分别被提呈到MHC-Ⅰ或MHC-Ⅱ类分子上,这种MHC分子复合物能够被T细胞识别从而激活T细胞相关功能。研究显示,放疗能够通过上调肿瘤细胞表面的MHC-Ⅰ类分子表达,增加CD8+及CD4+T淋巴细胞浸润及其对肿瘤细胞的抗原识别,以提高宿主免疫系统对于肿瘤细胞的识别杀伤能力;同时,通过对宫颈癌的临床样本进行单细胞转录组测序发现,放疗还可以上调宫颈癌上皮细胞的MHC-Ⅱ类基因表达,从而提高其免疫原性。
DC在放疗诱导的抗原提呈与免疫激活中发挥了重要作用。放疗能够促进抗原提呈细胞对肿瘤抗原的交叉提呈,增强抗原特异性的抗肿瘤免疫反应。同时,放疗还能增加抗原表位的扩散,即针对某种抗原或多种抗原产生的免疫应答能够促进抗原提呈细胞将不同抗原或多种抗原向T细胞呈递,刺激新抗原特异性T细胞的扩增。然而,肿瘤细胞往往会通过下调MHC-Ⅰ以逃避免疫识别。放疗能够上调肿瘤细胞表面MHC-Ⅰ的水平,使其更容易被细胞毒性T细胞识别和杀伤。也有研究对比了碳离子和光子放疗联合DC细胞疗法的效果,结果显示,碳离子放疗能够更好地激活DC,促进DC的成熟,从而抑制肿瘤的生长和转移。
3. 放疗重塑肿瘤免疫微环境:除了直接的肿瘤细胞杀伤作用,放疗还能够调节肿瘤免疫微环境,使其从“冷”肿瘤状态转变为“热”肿瘤状态。低氧、血管新生和免疫抑制是肿瘤微环境的突出特征。放疗能够将肿瘤微环境从免疫抑制表型重新编程为免疫刺激表型,表现为DC激活和呈递能力增强,CD8+T细胞浸润增加,肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)向M1极化以及多种细胞因子的产生。
不同的放疗方式对肿瘤免疫微环境的影响也不同。相对于常用的光子治疗,质子治疗由于其较高的相对生物学效应与“布拉格峰”的存在,能够更好地杀伤肿瘤和保护淋巴细胞,有研究报道了质子治疗相对于光子治疗,肿瘤微环境中浸润了更多的CD4+T细胞、自然杀伤细胞和更高水平的毒性细胞因子,激活了更强的抗肿瘤免疫。同样地,立体定向消融放疗也能够保护外周总淋巴细胞,从而产生更强的远隔效应。
其中,TAMs是肿瘤微环境中含量最多的免疫细胞,放疗显著地影响了TAMs的表型及功能。有研究显示,低剂量照射可使TAMs转化为M1 型TAMs,引起肿瘤血管的正常化, 1~10 Gy的中等剂量辐射通常诱导TAMs向M1型极化。在体外,2 Gy 5次的放疗后,人未极化单核细胞源性巨噬细胞向M1型 TAMs极化,表现为促炎标志物的上调以及抗炎标志物(M2表型)的下调。而体外消融剂量20 Gy的照射后,M1型Raw264.7巨噬细胞向M2型巨噬细胞重编程。照射后持续的M2表型是由于核因子κB(nuclear factor kappa-B, NF-κB)p50活化,导致白细胞介素-10(interleukin-10,IL-10 )产生增加和肿瘤坏死因子α分泌减少所造成的。
4. 放疗调控免疫检查点分子表达:一系列的临床前研究已经证实,放疗能够上调肿瘤细胞表面程序性死亡受体配体1(programmed cell death-ligand 1, PD-L1)的表达,这也为放疗和免疫治疗的联合提供了基础。在NSCLC、肝细胞癌、前列腺癌和结直肠癌等多种肿瘤中,研究者均观察到肿瘤细胞接受放疗后,其表面PD-L1水平有明显的升高,放疗通过多种机制诱导PD-L1上调,如ATM/ATR/Chk1激酶途径和cGAS-STING通路。
除了经典的免疫检查点分子PD-L1,放疗还能够上调肿瘤细胞表面CD47的表达水平。CD47作为巨噬细胞的免疫检查点,可以与巨噬细胞上的信号调节蛋白α(signal regulatory protein α, SIRPα)相互作用,发出“别吃我”的信号,结合并阻断SIRPα介导的肿瘤细胞吞噬作用,CD47抑制剂与放疗的联合在动物模型中也显示出较好的疗效。发表于Nature Cancer的研究显示,在SCLC中,放疗联合CD47抑制剂能够引起巨噬细胞介导的远隔效应,从而提升对肿瘤的控制效果。
临床问题 2
不耐受手术或拒绝手术的Ⅰ期NSCLC患者,是否可以在立体定向放射治疗(stereotactic body radiation therapy, SBRT)/立体定向消融放射治疗(stereotactic ablative body radiation, SABR)基础上联合免疫治疗?
共识意见:不耐受手术或拒绝手术的Ⅰ期NSCLC患者,SBRT/SABR是标准治疗,总体治疗效果好;SBRT/SABR基础上联合免疫治疗可否进一步提高疗效目前缺乏高级别证据,鼓励进行临床研究;对于存在高复发转移风险因素的患者,可考虑SBRT/SABR的基础上联合免疫治疗(推荐等级:强,证据级别:2类证据)。
对于不耐受手术或拒绝手术的Ⅰ期NSCLC患者,SBRT/SABR是临床标准治疗手段。然而,患者在接受SBRT治疗后仍存在较高的复发风险。RTOG 0236和RTOG 0915研究结果显示,接受单纯SBRT的Ⅰ期NSCLC患者的5年无进展生存率仅为30%左右,且复发风险随着肿瘤体积的增加而升高。此外,有研究提示,局晚期患者基线循环肿瘤DNA(circulating tumor DNA, ctDNA)水平及接受根治性放疗后ctDNA清除的情况与患者的预后或复发风险相关。因此,如何在SBRT的基础上进一步降低Ⅰ期不可手术或拒绝手术NSCLC患者的复发风险仍是目前尚需进一步探索的重要临床问题。
放疗已被证明能够对肿瘤微环境发挥免疫调节作用,且与放射剂量相关。临床前研究显示,当ICI药物与SBRT联合使用时,能够观察到很强的协同效应。对于免疫治疗联合SBRT在不耐受手术或拒绝手术Ⅰ期NSCLC临床治疗的探索,目前已有多项前瞻性小样本研究数据公布。其中无论SBRT同步或序贯免疫治疗均显示出可管理的不良反应。近期,一项Ⅱ期随机对照研究对比了N0M0期早期NSCLC患者接受SABR联合免疫治疗或SABR治疗的临床疗效,研究最终纳入141例T≤5 cm的早期患者(其中121例患者T≤3 cm),结果显示,SABR联合免疫治疗可显著提升患者4年无事件生存率(分别为77%和53%,HR=0.38),且不良反应可控。亚组数据显示,在T≤2 cm和T>2 cm且≤5 cm的两个亚组患者中,SABR联合免疫治疗对比SABR均显示获益趋势(HR=0.35,95% CI:0.14~0.86;HR=0.40,95% CI:0.14~1.20),该研究结果为Ⅰ期不耐受手术或拒绝手术的NSCLC患者在SBRT的基础上联合免疫治疗提供了证据。对于N0M0期的早期NSCLC患者,目前已开展多项探索SBRT联合免疫治疗的Ⅲ期临床研究(PACIFIC-4、KEYNOTE-867和SWOG研究)。近期,KEYNOTE-867研究(SBRT联合帕博利珠单抗对比SBRT)由于在中期分析中疗效不达预期而终止,详细研究结果尚未公布。因此,SBRT联合免疫治疗方案治疗不耐受手术Ⅰ期NSCLC患者的适宜人群和最佳治疗方案仍需更多高质量的临床研究探索与验证。
临床问题 3
驱动基因阴性不耐受手术或拒绝手术的Ⅱ期NSCLC患者,是否可选择在(化)放疗基础上联合免疫巩固治疗(PACIFIC模式)?
共识意见:对于驱动基因阴性不耐受手术或拒绝手术的Ⅱ期NSCLC患者可在(化)放疗基础上联合免疫巩固治疗,但有待高级别循证医学证据的验证(推荐等级:强,证据级别:3类证据)。
不耐受手术或拒绝手术的Ⅱ期NSCLC患者标准治疗仍为放疗或同步放化疗(concurrent chemoradiotherapy, cCRT)及序贯放化疗(sequential radiochemotherapy, sCRT)。Ⅲ期临床研究PACIFIC和GEMSTONE-301研究证实,不可手术的Ⅲ期NSCLC患者在同步及序贯放化疗后免疫巩固治疗能显著改善患者的生存,但这些前瞻性临床研究均未纳入不耐受手术或拒绝手术的Ⅱ期NSCLC患者。一项回顾性研究中,学者分析了326例在完成放化疗后序贯接受度伐利尤单抗治疗的NSCLC患者的临床数据,其中包括29%的Ⅰ/Ⅱ期NSCLC患者,结果显示,中位随访13.1个月,有33%的患者发生疾病进展,但该研究并未进一步披露Ⅰ/Ⅱ期患者的临床数据。因此,对于驱动基因阴性[排除表皮生长因子受体(epidermal growth factor receptor, EGFR) 19缺失或L858R、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)重排]不耐受手术的Ⅱ期NSCLC患者可以参考PACIFIC研究模式治疗,但仍缺乏高级别的循证医学证据的补充验证。
临床问题 4
驱动基因阴性不可手术Ⅲ期NSCLC患者,在根治性放化疗后序贯免疫巩固治疗时,免疫治疗启动的时间和治疗时长的考量?
共识意见:驱动基因阴性不可手术Ⅲ期NSCLC,在放化疗后不良反应恢复至不良事件通用术语评价标准(common terminology criteria for adverse events, CTCAE) 0~1级后,可尽早启动免疫巩固治疗;免疫巩固治疗时长建议为1~2年(推荐等级:强,证据级别:1类证据)。
PACIFIC和GEMSTONE-301研究证实,不可手术的Ⅲ期NSCLC患者在cCRT/sCRT后免疫巩固治疗能显著改善患者的生存,免疫巩固治疗已成为指南推荐的标准治疗,但并没有明确规定免疫启动的时间和治疗时长。PACIFIC研究方案规定,患者在完成最后一次放疗后1~42 d内,不良反应恢复至CTCAE 0~1级的患者被随机分配到度伐利尤单抗组或安慰剂组,该研究分析了度伐利尤单抗启动时间与疗效获益的关系,结果显示,以放疗后14 d为界值,早启动度伐利尤单抗巩固治疗对比晚启动治疗的患者无进展生存时间(progression free survival, PFS)和总生存时间(overall survival,OS)更好(PFS HR=0.39,OS HR=0.42)。PACIFIC-R研究允许42 d后启动度伐利尤单抗,以放疗后42 d为界值,相较于晚启动治疗的患者,早启动度伐利尤单抗治疗真实世界PFS(real-world PFS, rwPFS)数值有延长的趋势(中位rwPFS:25.7和20.8个月)。
TORG1973研究前瞻性的探索了放疗完成后立即进行免疫巩固治疗的疗效及安全性,患者接受2个周期的铂类双药化疗联合60 Gy放疗,随后从最后一次放疗后的次日(最多5 d内)开始度伐利尤单抗治疗,1年无进展生存率为75.0%,中位PFS仅为14.2个月,3/4级肺炎和发热性中性粒细胞减少症的发生率均为4.3%,证实在cCRT后立即启动免疫巩固治疗耐受性良好。一项Meta分析纳入了9项临床研究,旨在分析免疫巩固治疗起始时间(放疗结束42 d内和42 d后)与安全性(主要终点:≥3级肺炎)和疗效(次要终点:PFS)的关系,结果显示,早启动免疫治疗并不增加≥3级肺炎的发生(分别为4.12%和6.9%),1年无进展生存率相似(分别为61.03%和56.40%)。另一项仅纳入真实世界数据的Meta分析也显示,放疗后42 d内接受度伐利尤单抗治疗的患者与42 d后接受治疗患者具有相近的1年无进展生存率(分别为62%和62%)和1年总生存率(分别为96%和85%)。另外有研究表明,单纯放化疗治疗或放化疗后使用度伐利尤单抗巩固治疗均可能有迟发性放射性肺炎,因此,延迟免疫启动时间并不增加安全性。综上,建议临床医师仔细评估每位患者的具体情况,在放化疗后不良反应恢复良好的情况下,可尽早启动免疫治疗。
对于驱动基因阴性不可手术Ⅲ期NSCLC患者,使用放化疗后序贯免疫治疗的两个随机对照Ⅲ期研究中,PACIFIC研究方案规定巩固治疗时长为1年,GEMSTONE-301研究方案规定巩固治疗时长为2年,因此建议免疫巩固治疗时长为1~2年。考虑到不可手术Ⅲ期NSCLC患者免疫巩固治疗停药后仍有复发的可能,建议停药后需规律随访与监测。一项Meta分析纳入了38项放化疗后免疫巩固治疗Ⅲ期NSCLC患者的研究,分析了免疫治疗持续时间与获益的关系,发现接受2年免疫治疗的患者对比接受1年免疫治疗的患者具有更高的24个月总生存率(分别为77.4%和60.7%),没有增加≥3级肺炎的发生率。正在进行中的Ⅲ期PACIFIC-5研究,放化疗后序贯度伐利尤单抗巩固治疗或安慰剂治疗直至出现疾病进展,未来有望回答免疫巩固治疗时长与临床获益的关系。
临床问题 5
驱动基因阴性不可手术Ⅲ期NSCLC,是否可以将免疫治疗提前到cCRT阶段?
共识意见:驱动基因阴性不可手术Ⅲ期NSCLC患者,基于现有临床研究结果,目前不推荐将免疫治疗提前到cCRT阶段(推荐等级:强,证据级别:1类证据)。
免疫治疗提前到cCRT的模式,一方面可以解决在行cCRT治疗期间患者疾病进展导致无法接受后续免疫巩固治疗的情况,从而扩大获益人群;另一方面,cCRT阶段联合免疫治疗潜在进一步提升疗效。早期的多项Ⅱ期探索性研究结果显示,程序性死亡受体1(programmed cell death-1, PD-1)/PD-L1抑制剂联合cCRT治疗改善了临床疗效,包括KEYNOTE-799(NCT03631784)、DETERRED、NICOLAS(NCT02434081)研究,1年无进展生存率和客观有效率(objective response rate, ORR)在数值上都有一定提升,同时安全性可控。但Ⅲ期研究PACIFIC-2度伐利尤单抗提前到cCRT组(试验组)对比安慰剂同步cCRT组及安慰剂巩固(对照组)并未达到主要研究终点,中位PFS分别为13.8和9.4个月(HR=0.85,95% CI:0.65~1.12,P=0.247),同时OS也没有显著差异,中位OS分别为36.4和29.5个月(HR=1.03,95% CI:0.78~1.39,P =0.823);安全性方面,试验组与对照组相比,3/4级任何原因的不良事件发生率分别为53.4%和59.3%;导致治疗停止的不良事件发生率分别是25.6%和12.0%(前4个月分别为14.2%和5.6%);肺炎/放射性肺炎的发生率分别为28.8%和28.7%。大部分患者于治疗开始后的前4个月内停药(分别为 14.2% 和 5.6%),也就是cCRT期间停药,表明免疫治疗的引入降低了患者对cCRT的耐受性,进而影响了疗效,这可能是造成PACIFIC-2研究失败的潜在原因。同样,CheckMate-73L评估纳武利尤单抗联合cCRT治疗后,纳武利尤单抗联合伊匹木单抗巩固治疗对比PACIFIC模式未达到主要研究终点,详细的数据还没有披露。目前仍有两项Ⅲ期临床研究KEYLYNK-012(NCT04380636)及ECOG-ACRIN EA5181(NCT04092283)研究探索免疫治疗提前到cCRT阶段的模式尚在进行中,期待两项研究的结果将进一步明确将免疫治疗提前到cCRT阶段的可行性。
临床问题 6
EGFR突变不可手术Ⅲ期NSCLC患者,选择在根治性放化疗后序贯免疫巩固治疗,还是EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)巩固治疗?
共识意见:EGFR敏感突变(Ex19del/L858R)不可手术Ⅲ期NSCLC患者,推荐对根治性放化疗后无进展的患者进行EGFR-TKI巩固治疗(推荐等级:强,证据级别:1类证据)。
PACIFIC研究支持度伐利尤单抗巩固治疗为根治性放化疗后未进展的不可手术Ⅲ期NSCLC患者的标准治疗,该研究纳入了35例EGFR突变型NSCLC患者,其中24例接受了度伐利尤单抗巩固治疗,11例接受了安慰剂巩固治疗,亚组分析的结果显示,在EGFR突变患者中度伐利尤单抗巩固治疗对比安慰剂未能改善PFS(中位PFS分别为11.2和10.9个月,HR=0.91)和OS(中位OS分别为46.8和43.0个月,HR=1.02)。GEMSTONE-301研究未纳入EGFR突变患者。LAURA研究是首个在EGFR敏感突变(Ex19del/L858R)Ⅲ期不可切除NSCLC中采用根治性同步/序贯放化疗后奥希替尼巩固治疗的Ⅲ期临床研究,研究结果证实,奥希替尼组对比安慰剂组显著改善PFS(中位PFS分别为39.1和5.6个月,HR=0.16,P<0.001),同时奥希替尼组可明显减少中枢神经系统新发病灶的产生(分别为8%和29%),OS数据尚未成熟,安全性整体可控。一项回顾性真实世界研究评估了该人群接受奥希替尼、度伐利尤单抗或观察的获益,结果显示奥希替尼治疗组2年rwPFS获益最大(分别为86%、30%和27%)。
临床问题 7
KRAS突变、ALK重排不可手术Ⅲ期NSCLC患者,选择在根治性放化疗后序贯免疫巩固治疗,还是靶向巩固治疗?
共识意见:KRAS突变不可手术Ⅲ期NSCLC患者,根治性放化疗后无进展的患者可选择免疫巩固治疗;ALK重排的不可手术Ⅲ期NSCLC患者,根治性放化疗后可考虑ALK-TKI巩固治疗,但缺乏高级别循证医学证据,鼓励参加相关临床试验(推荐等级:强,证据级别:3类证据)。
Ⅲ期临床研究PACIFIC和GEMSTONE-301(排除已知的ALK和ROS1,允许状态未知患者入组)并未公布KRAS突变患者以及其他罕见驱动基因阳性患者的亚组疗效和安全性数据。一项度伐利尤单抗巩固治疗的Ⅲ期不可切除NSCLC患者的回顾性真实世界研究纳入了323例患者,其中43例伴驱动基因阳性,包括KRAS突变(26例,其中8例KRAS G12C突变)、BRAF突变(5例,其中4例BRAFV600E突变)、ALK重排(4例)和其他(27例),驱动基因阳性患者较其他患者PFS无显著差异(中位PFS分别为14.9和18个月,P=1.0),而KRASG12C患者对比EGFR组或BRAF突变患者PFS获益更大(中位PFS分别为未达到、8.1和7.8个月,P=0.02)。一项回顾性分析KRAS突变患者免疫巩固治疗是否获益的研究纳入39例患者,KRAS突变18例,其他驱动基因突变7例,驱动基因阴性14例,KRAS突变患者PFS与驱动基因阴性患者相似(中位PFS分别为12.6和12.7个月,P=0.77)。一项回顾性分析对比了KRAS突变(42例)和KRAS野生型(114例)NSCLC患者放化疗后免疫巩固治疗的疗效,KRAS 突变患者的PFS较差(中位PFS分别为6.3和10.7个月,P=0.041),但OS相似(中位OS分别为23.1和27.3个月,P=0.237),研究结果显示,KRAS突变与较差的PFS相关,但不影响OS获益,主要是与ICI巩固治疗前的快速进展相关。
一项国际多中心回顾性研究分析了2015—2022年间接受同步放化疗后使用ALK-TKI、度伐利尤单抗治疗或仅观察的ALK重排不可切除Ⅲ期NSCLC患者的疗效。15例患者接受了ALK-TKI,30例患者接受了度伐利尤单抗,19例患者接受了单独观察;ALK-TKI组对比度伐利尤单抗组或观察组的rwPFS显著延长(中位rwPFS:未达到、11.3和7.4个月,P<0.05),ALK-TKI组对比度伐利尤单抗组或观察组的3年总生存率更高(分别为100%、90.5%、63.5%)。此结果显示ALK重排不可切除Ⅲ期NSCLC从ALK-TKI靶向巩固治疗获益更多,但样本量有限,有待高级别研究证据的验证。由于其他罕见突变的发生率低,因此这些免疫巩固治疗不可切除Ⅲ期NSCLC的真实世界的研究均未单独报道ROS1重排、BRAF突变等罕见突变患者的亚组数据。
临床问题 8
PD-L1阴性(肿瘤细胞,tumor cell TC;TC<1%)的驱动基因阴性不可手术Ⅲ期NSCLC患者,是否选择在(化)放疗基础上联合免疫巩固治疗?
共识意见:PD-L1阴性(TC<1%)的驱动基因阴性不可手术Ⅲ期NSCLC患者可在(化)放疗基础上联合免疫巩固治疗(推荐等级:强,证据级别:2类证据)。
PACIFIC研究显示,度伐利尤单抗的获益与PD-L1表达水平相关,TC<1%亚组,中位PFS分别为10.7和5.6个月(HR=0.73,95% CI:0.48~1.11),中位OS分别为33.1和45.6个月(HR=1.14,95% CI:0.71~1.84);TC≥1% 的亚组,中位PFS分别为17.8和5.6个月(HR=0.46,95% CI:0.33~0.64),提示度伐利尤单抗在PD-L1阴性(TC<1%)人群观察到PFS获益,但未观察到OS获益。基于此,在欧盟获批的适应证中,度伐利尤单抗在局部晚期NSCLC患者中的使用仅限于PD-L1阳性(TC≥1%)的患者,而国内国家药品监督管理局的授权信息没有限制PD-L1的表达。在PACIFIC-R研究中,同样观察到PD-L1阳性患者较阴性患者更好的获益,但PD-L1阴性(TC<1%)患者亦观察到令人鼓舞的结果,估计超过50%的患者生存时间超过3年(全人群3年总生存率约60%)。一项系统综述和荟萃分析结果显示,PD-L1≥1%的患者在接受放化疗后使用ICI巩固治疗的OS和PFS均优于PD-L1<1%的患者;对于PD-L1<1%的患者,放化疗后使用ICI巩固治疗相比单独放化疗能显著提高3年总生存率和2年无进展生存率,说明针对PD-L1<1%的患者,放化疗后使用ICI巩固治疗都能带来生存益处。同时,有研究显示,放化疗影响局部晚期NSCLC患者PD-L1表达。多中心回顾性研究共分析了来自6个中心的31例PD-L1阴性局部晚期NSCLC患者,在14例患者(45%)中,PD-L1表达在放化疗前后的样本中显著增加,PD-L1表达未改变或增加的患者中位PFS分别为10和16.9个月。因此,在放化疗后,可考虑对PD-L1阴性的局部晚期NSCLC患者重新确定PD-L1表达,其价值和意义有待进一步研究验证。
临床问题 9
驱动基因阴性不可手术Ⅲ期NSCLC患者,是否可考虑化免诱导治疗后序贯放(化)疗及免疫巩固的治疗(夹心饼模式)?适用于哪些人群?
共识意见:驱动基因阴性不可手术Ⅲ期NSCLC患者,对于肿瘤负荷大且耐受性良好的患者可以考虑化免诱导治疗后序贯放(化)疗及免疫巩固的治疗(夹心饼模式;推荐等级:强,证据级别:2类证据)。
PACIFIC研究确立了cCRT后免疫巩固治疗的新标准(PACIFIC模式),值得注意的是,PACIFIC研究中52.9%的患者为ⅢA期;Ⅲ期患者中大体积肿瘤患者的治疗仍然具有挑战性,包括可能由于放疗期间的靶区体积过大增加的肺不良反应风险以及肿瘤内部缺氧导致的放射抗性。化免诱导治疗后序贯放(化)疗及免疫巩固治疗的策略(夹心饼模式),可以缩小初始肿瘤体积,提高后续根治性治疗的成功率,进而改善大体积肿瘤患者的生存。一项研究针对原发肿瘤最大长径≥5 cm或区域淋巴结最短长径≥2 cm的Ⅲ期不可切除NSCLC,给予化免诱导治疗后序贯同步及序贯放化疗±免疫巩固的治疗,共纳入75例患者,诱导治疗的ORR为76.1%,诱导治疗+放化疗后的ORR为86.7%;中位OS未达到,2年总生存率为75.1%,中位PFS为30.6个月,2年无进展生存率为64.2%;整体耐受性良好,≥3级肺炎的发生率为9.3%。一项Ⅱ期随机对照CA209-7AL研究探索了化免诱导治疗序贯放化疗后免疫巩固治疗对比仅观察的疗效与安全性,264例患者接受2个周期的纳武利尤单抗联合化疗诱导治疗,中间采用放化疗,巩固阶段将患者随机分入纳武利尤单抗巩固组(n=86)和观察组(n=86)。结果显示,与观察组相比,纳武利尤单抗巩固组的PFS明显延长(中位PFS分别为未达到和12.2个月,HR=0.49,P=0.003);整体耐受性良好,≥3级肺炎在新辅助治疗期间的发生率只有1.1%,在同期放化疗期间为2.5%,纳武利尤单抗巩固治疗组的≥3级肺炎发生率仅为3.5%,与观察组2.3%相仿;亚组分析结果显示,分期较晚的ⅢB和ⅢC患者获益更显著。一项Ⅱ期、两队列研究GASTO-1086,旨在评估化疗联合替雷利珠单抗±贝伐珠单抗诱导治疗后,序贯放化疗治疗和替雷利珠单抗巩固治疗在不可手术Ⅲ期NSCLC中的疗效和安全性,结果显示,早期肿瘤退缩显著,ORR分别为89.7%(26/29)和92.3%(24/26)。一项单臂多中心Ⅱ期研究探索阿替利珠单抗诱导治疗后序贯放化疗及阿替利珠单抗巩固治疗Ⅲ期不可切除NSCLC,62例患者接受了阿替利珠单抗诱导治疗,诱导阶段ORR为27.4%,疾病控制率(disease control rate, DCR)为74.2%,有11例患者因为疾病进展未能接受放化疗治疗,提示免疫单药诱导治疗存在不足。
对于不可手术切除Ⅲ期患者,目前有研究在探索基于诱导阶段免疫治疗肿瘤退缩的情况选择根治手段,转化成功的患者进行手术治疗及术后免疫辅助治疗,仍不适合手术的患者可以接受根治性放化疗及免疫巩固治疗。一项Ⅱ期探索性研究评估SHR-1701联合或不联合化疗诱导治疗,随后进行手术或放疗,然后进行巩固SHR-1701治疗不可切除的Ⅲ期NSCLC,27例患者接受了手术(病理完全缓解7例),18个月无事件生存率为74.1%;59例患者接受了放化疗,18个月无事件生存率为57.3%。另一项临床研究纳入59例不可手术Ⅲ期NSCLC,给予替雷利珠单抗联合化疗诱导治疗,根据诱导治疗的反应选择根治性手术或放疗,其中16例患者接受了根治性手术(病理完全缓解9例),42例患者接受了根治性胸部放疗,整体人群疗效良好,中位PFS为32.2个月,24个月无进展生存率为77.6%。期待未来更多研究数据的验证。
临床问题 10
术后局部复发的驱动基因阴性NSCLC患者,是否可选择放化疗后免疫巩固治疗(PACIFIC研究模式)?
共识意见:术后局部复发的驱动基因阴性NSCLC患者,应根据局部复发后情况进行再分期,经多学科团队(multidisciplinary team, MDT)讨论后选择放化疗的患者可以在放化疗后序贯免疫巩固治疗(推荐等级:强,证据级别:3类证据)。
接受手术切除的NSCLC患者存在不同比例的复发,且复发风险与患者病理分期相关。其中,研究显示,高达75%接受单纯手术的Ⅲ期NSCLC患者在术后5年会发生复发。根据患者术后复发模式,可区分定义为局部复发和系统性复发。各项研究中,NSCLC患者术后发生仅局部复发的风险为8%~37%。在CheckMate 816研究中,接受新辅助化免治疗的患者对比单纯化疗新辅助术后总体复发率降低(分别为28%和42%),但术后局部复发率相近(分别为19%和22%)。临床对于术后复发的患者应该进行重新分期,依据分期情况选择治疗方案。对于术后局部复发的NSCLC,放化疗是更为常见的治疗选择。对于Ⅲ期不可手术的NSCLC患者,PACIFIC与GEMSTONE-301研究证明,相比于单纯放化疗,放化疗序贯免疫治疗可显著提升患者PFS和OS。近期,回顾性研究结果提示,放化疗序贯免疫治疗能为术后局部复发的NSCLC患者带来临床获益。其中,一项回顾性研究纳入24例术后局部复发且在之后接受cCRT序贯度伐利尤单抗治疗的NSCLC患者,研究结果显示,患者2年无进展生存率为34.3%,18个月总生存率为82.8%。另一项回顾性研究共纳入196例术后局部复发NSCLC患者,对比复发后接受不同治疗模式的临床数据,结果显示,与接受单纯cCRT相比,接受cCRT序贯免疫治疗的患者经逆概率加权法校正后的中位PFS(分别为25.4和11.5个月,HR=0.44)和OS(分别为未达到和未达到,HR=0.49)获得显著提升。然而,目前尚缺乏前瞻性证据说明放化疗序贯免疫治疗对比单纯放化疗的优势作用。
临床问题 11
在接受免疫围术期治疗的驱动基因阴性可手术Ⅲ期NSCLC患者,是否需要联合术后放疗(postoperative radiotherapy, PORT),适用什么人群?
共识意见:对于接受新辅助免疫治疗且术后证实完全切除的驱动基因阴性可手术Ⅲ期NSCLC患者,常规不需要进行PORT,仅对经过MDT讨论认为局部复发风险较高时可选择PORT治疗(推荐等级:中,证据等级:3类证据)。
1998—2006年美国国家癌症数据库分析了30 552例R0切除的Ⅱ~ⅢA期NSCLC患者,其中3 430例患者接受PORT,研究发现,与术后未接受放疗者相比,PORT降低了N0期(分别为48%和37.7%,P<0.001)和N1期患者(分别为39.4%和34.8%,P<0.001)的5年生存率;而N2期患者在接受PORT后5年生存率得到提高(分别为27.8%和34.1%,P<0.001)。但近期两项Ⅲ期研究Lung ART和PORT-C均未能证实PORT治疗能够改善pN2患者的无病生存。近期随着多项Ⅲ期临床研究的成功,围术期免疫治疗已成为驱动基因阴性可手术Ⅲ期NSCLC患者的标准治疗方案。IMpower010和KEYNOTE-091两项探索免疫辅助治疗的Ⅲ期随机对照研究未允许入组接受PORT的患者,而在其他探索免疫新辅助±辅助围术期治疗NSCLC的随机对照研究中,一般规定需根据患者术后淋巴结病理以及当地治疗标准等对适宜人群进行PORT,且大部分研究规定PORT需在免疫辅助治疗开启之前完成,目前这些临床研究都没有报道PORT实际使用情况和疗效数据。在一项探索PORT优势获益人群的回顾性小样本分析中,是否接受免疫治疗未展示出与PORT后患者局部复发风险的相关性。目前,尚缺乏基于围术期免疫治疗模式下的PORT相关临床数据,尚需真实世界证据和临床试验的补充验证,以筛选PORT适宜人群。
临床问题 12
对于肺上沟瘤(superior sulcus tumor, SST)患者,是否考量在标准治疗新辅助放化疗的基础上联合免疫治疗?手术切除后或是新辅助治疗后不可手术的患者是否推荐进行免疫辅助/巩固治疗?
共识意见:SST患者在标准新辅助放化疗后,对于可手术的患者可在术后选择免疫辅助治疗,对于不可手术的患者可在根治性放疗后选择免疫巩固治疗(推荐等级:强,证据级别:3类证据)。
SST是一种相对罕见且最难治疗的NSCLC类型之一。SST通常涉及颈胸区的重要结构,由于这些重要器官的紧密接近,手术切缘难以保证,治疗效果较差。20世纪90年代开展的SWOG9416/INT0160研究和JCOG9806研究证实新辅助放化疗后能够为SST患者提供更大手术机会和临床获益,两项研究分别纳入104例和76例患者,R0切除率分别为76%和68%,完全病理缓解率分别为56%和23%,5年总体生存率分别为44%和56%。尽管SST患者治疗效果有很大改善,但远处复发(包括脑转移)的发生率仍然很高,SST患者需要更有效的治疗方案。近期多项Ⅲ期临床研究显示,免疫新辅助和辅助治疗可以显著改善可手术NSCLC患者的生存,但这些研究中均未纳入(或未报道)SST患者。两项病例报道显示,新辅助化疗联合免疫治疗SST患者疗效突出,分别为纳武利尤单抗或替雷利珠单抗联合含铂双药化疗,2例患者均实现病理完全缓解,获得显著的影像学肿瘤退缩(分别缩小68%和71%),患者均实现了R0切除,其中1例患者术后继续进行了替雷利珠单抗辅助治疗。基于SST治疗未被满足的临床需求,以及免疫治疗在其他肺癌人群中的突出疗效,JCOG1807C(DEEP_OCEAN,NCT04465968)为一项探索标准放化疗治疗基础上联合免疫治疗SST患者的多中心单臂确证性研究,患者接受诱导放化疗和2周期度伐利尤单抗治疗,随后进行可切除SST的手术切除;术后进行22周期度伐利尤单抗治疗,对于不可切除的SST,在诱导度伐利尤单抗治疗后再进行22周期度伐利尤单抗治疗,该研究主要终点为OS,预期3年总生存率66%提升至80%,样本量为84例,安全性队列2例患者已完成术后30 d随访,安全性良好,期待未来进一步公布研究结果。
临床问题 13
什么是寡转移以及寡转移患者的分类?
共识意见:寡转移是指转移数量有限的肿瘤状态,一般认为转移器官≤3个、转移病灶≤5个,寡转移患者通过系统治疗与局部治疗的整合方式有望实现根治或长期的疾病控制。根据既往转移病史,寡转移患者可以分为初始寡转移、重复寡转移和诱导寡转移;根据诊断时是否有系统治疗和病灶进展,又可以分为寡复发、寡进展和寡残留;根据转移灶与原发灶诊断间隔,可分为同时性寡转移和异时性寡转移(推荐等级:强,证据级别:2类证据)。
寡转移性疾病是Hellman和Weichselbaum于1995年首次提出的一个独特的恶性肿瘤状态,介于局部性疾病和全身转移性疾病之间,在这种状态下,患者的转移数量和位置有限,尽管寡转移尚无统一的严格定义,但一般认为转移器官≤3个及转移病灶≤5个,也有研究认为寡转移疾病没有最大转移数量的限制。既往有研究证据显示,寡转移NSCLC患者局部治疗能显著的延长PFS和OS,目前有多个临床试验正在进行中(NCT02417662,NCT03862911,NCT03721341),以评估局部消融治疗与系统治疗的最佳整合方式。
2020年ESTRO和EORTC研究建立了一个全面的寡转移性疾病特征和分类系统,将寡转移分为9类,建议在所有接受根治性局部治疗的寡转移性疾病患者中评估这些特征,同时也有助于临床实践中指导寡转移患者的治疗决策。根据寡转移诊断时既往转移病史情况,分为初始寡转移(无寡转移病史)、重复寡转移(有寡转移根治病史)和诱导寡转移(有多发转移病史);初始寡转移患者又根据寡转移灶出现与原发肿瘤诊断的时间间隔(6个月)分为同时性寡转移性疾病和异时性寡转移;根据寡转移诊断时是否有系统治疗,异时性寡转移又可分为寡复发和寡进展;根据寡转移诊断时是否有系统治疗,以及病灶是否进展,重复寡转移可以分为重复寡复发、重复寡进展和重复寡残留,诱导寡转移(有多发寡转移治疗病史)可以分为诱导寡复发、诱导寡进展和诱导寡残留;共计9种不同状态的寡转移性疾病。
由于上述9分类方式在2020年制定时纳入较少的免疫耐药后进展患者,因此,基于免疫耐药后的一项大规模真实世界研究将转移性NSCLC患者接受免疫治疗耐药后的进展模式分为4种:重复寡进展(伴寡转移性疾病史的寡进展)、诱导寡进展(伴多发转移性疾病史的寡进展)、新生多发性进展(伴寡转移性疾病史的多发性进展)和重复多发性进展(伴多发转移性疾病史的多发性进展),可以依据进展模式指导治疗策略的选择。
临床问题 14
晚期寡转移NSCLC患者,在系统(化)免治疗基础上联合局部放疗的人群选择?不同寡转移患者放疗与系统治疗的时序安排?
共识意见:对于晚期寡转移NSCLC患者可考虑在系统(化)免治疗的基础上联合局部放疗,应充分评估技术上可行且临床安全;对于有症状的病灶建议优先局部处理;同时性初始寡转移患者推荐先进行系统(化)免治疗后再进行局部放疗,放疗完成后继续免疫维持治疗;对于寡进展的患者,局部治疗应充分考虑获益和风险比,MDT讨论后确定是否进行局部放疗及调整系统治疗(推荐等级:强,证据级别:3类证据)。
多项研究显示了在系统(化)免治疗基础上联合局部放疗能给不同类型的寡转移患者带来临床获益(表2),但大多研究中纳入的寡转移患者的类型存在异质性,研究中探索了不同的系统(化)免治疗与放疗联合的实现安排,以早期数据为主,有待高级别循证医学证据的进一步验证。对于寡转移局部放疗的人群和治疗时序的选择,可以参考ASTRO/ESTRO针对NSCLC寡转移治疗的指南,对于寡转移NSCLC患者,应优先进行症状性病灶的根治性局部治疗,如有症状脑转移患者优先进行脑转移病灶的放疗。对于初始寡转移患者,建议在标准系统(化)免治疗基础上,对所有恶性肿瘤部位(同时性寡转移)或复发部位(异时性寡转移)进行根治性局部治疗。对于同步寡转移NSCLC患者,推荐先进行至少3个月的系统治疗且整体控制良好的情况下进行根治性局部放疗,并建议在完成根治性局部治疗后进行免疫维持治疗;放疗阶段是否需要中断系统治疗,建议根据放疗部位及患者耐受性等个体化分析。对于诱导寡转移患者(寡残留、寡进展),可以在继续(化)免治疗的基础上,对所有持续存在的或有进展的恶性肿瘤部位进行局部治疗。对于重复性寡转移患者,之前接受过根治性局部治疗的寡转移NSCLC患者,如果随后出现广泛的疾病进展或复发,推荐系统治疗作为首选治疗方案,建议通过MDT讨论额外的局部治疗,如果局部治疗的不良反应在MDT和患者可接受的范围内。这些推荐旨在通过优化系统治疗和局部治疗的顺序和时间安排,最大限度地提高寡转移NSCLC患者的治疗效果。


临床问题 15
晚期寡转移NSCLC患者,在系统(化)免治疗基础上联合局部放疗的分割方式和剂量(SBRT、传统分割)?
共识意见:晚期寡转移NSCLC患者推荐使用基于风险调整的放疗策略,优先SBRT、根据疾病位置和肿瘤负荷大小等可选择大分割放射治疗或传统分割放疗;建议给予根治性的剂量以实现较好的局部控制(推荐等级:强,证据级别:3类证据)。
ASTRO/ESTRO针对NSCLC寡转移治疗的指南推荐使用基于风险调整的放疗策略,优先SBRT、根据疾病位置和肿瘤负荷大小等可选择大分割放射治疗或传统分割放疗。实施局部治疗主要注意:持久的局部控制定义为2年内至少85%的局部控制;单独使用SBRT时,较高的生物等效剂量(biologically equivalent dose assuming an α/β=10, BED10;通常>75 Gy)与最佳局部控制相关;较低的BED10(50~75 Gy范围)在结合系统治疗和SBRT的情况下,通常能达到可接受的局部控制。
目前,免疫联合放疗在晚期NSCLC患者中的探索以SBRT或SABR为主(表2),多项早期研究显示了良好的治疗活性和安全性。近期Ⅱ/Ⅲ期NRG-LU002研究因为中期分析PFS终点未达到预期而提前终止,该研究对转移灶进行SBRT,原发灶选择大分割放疗,但免疫联合放疗对比单纯免疫维持并未显著改善PFS。部分免疫联合治疗晚期NSCLC患者的研究提示,相较于传统分割放疗,SBRT联合免疫治疗显示更好的疗效获益。一项回顾性研究评估321例转移性NSCLC患者,其中107例接受PD-1/PD-L1抑制剂联合放疗,73例接受传统放疗+PD-1/PD-L1,34例接收SBRT+ PD-1/PD-L1,中位PFS分别为13.9和8.3个月(HR=0.58,95% CI:0.38~0.87),中位OS分别为30.6和20.9个月(HR=0.54,95% CI:0.33~0.9)。MDACC研究中有20例患者接受帕博利珠单抗+传统放疗,16例接受帕博利珠单抗+SBRT,帕博利珠单抗+SBRT对比帕博利珠单抗+传统放疗在放射野外的ORR分别为38%和10%,中位PFS分别为20.8和6.8个月(HR=2.67,95% CI:1.07~6.72)。
低剂量放疗可能增强免疫治疗联合SBRT治疗的协同抗肿瘤效果。一项前瞻性Ⅰ期研究共招募了29例晚期一线NSCLC患者,包含剂量递增和剂量扩展阶段,患者接受SBRT(30 Gy/3次)治疗小病灶,同时接受低剂量放疗(2 Gy/1次,4 Gy/2次,或10 Gy/5次)治疗大病灶,随后接受信迪利单抗治疗,剂量爬坡确定推荐的低剂量放疗剂量为4 Gy/2次,安全性良好,初步显示抗肿瘤活性,确认的ORR为57.1%,中位PFS为8.6个月,中位OS尚未达到。这种高低剂量联合的放疗方案有待进一步研究证据的验证。
临床问题 16
伴有脑转移的晚期NSCLC患者(无症状脑转移、有症状脑转移),在(化)免系统治疗的基础上是否联合颅脑放疗及介入时机?
共识意见:对于无症状的脑转移患者,优先考虑接受系统免疫治疗,局部治疗可适当延迟;对于有症状的脑转移患者,应积极进行局部治疗,依据患者的身体情况决定系统免疫治疗介入的时机(推荐等级:强,证据级别:3类证据)。
硬脑膜窦中功能性淋巴管的发现,奠定了免疫治疗在脑转移患者良好疗效的理论基础,针对无症状或经治稳定的脑转移的3项临床研究分别证实无症状脑转移患者可以从替雷利珠单抗、阿替利珠单抗、卡瑞利珠单抗免疫治疗中获益(中位PFS:7.4~8.9个月,颅内ORR为42.7%~56.7%,颅内1年无进展生存率为41.9%~56.5%)。随着免疫治疗在脑转移患者中证据的积累,无症状脑转移患者可优先行免疫系统治疗,基于MDT的讨论决定局部治疗的介入时机。
目前尚缺乏免疫治疗基础上联合脑放疗方案探索的高级别循证医学证据,仍需参考化疗时代脑转移的放疗推荐。立体定向放射外科(stereotactic radiosurgery, SRS)治疗的主要适用于:(1)单发长径4~5 cm以下的转移瘤的初程治疗;(2)≤4个转移灶的初程治疗;(3)全脑放射治疗(whole brain radiotherapy,WBRT)失败后的挽救治疗;(4)颅内转移灶切除术后的辅助治疗;(5)既往接受SRS治疗的患者疗效持续时间超过6个月,且影像学认为肿瘤复发而不是坏死,可再次考虑SRS;(6)局限的脑膜转移灶WBRT基础上的局部加量治疗。对不适合SRS的患者可以选择WBRT或WBRT联合SRS。
目前对于有症状脑转移患者接受局部治疗的同时,系统性免疫治疗的介入时机有多项研究探索,同步进行或可有更大的临床获益。一项回顾性研究纳入的163例患者中,有50例接受了ICI联合放疗,113例接受单独放疗,放疗方式包括SRS(58%)、部分脑照射(17%)和WBRT(62%);其中有48%为有症状脑转移患者,研究显示,ICI联合放疗和单独放疗患者在各级不良事件的发生率上没有显著差异。此外,分析ICI与放疗联合的不同时序,不良事件发生率也没有差异。一项前瞻性单臂Ⅰ/Ⅱ期研究显示,纳入适合SRS的NSCLC活动性脑转移患者,同时(7 d内)给予脑SRS和纳武利尤单抗及伊匹木单抗的全身治疗,10例可评估的患者全身治疗和放射治疗的中位间隔为3 d,仅有1例患者产生剂量限制性不良反应,且4个月的颅内无进展生存率为70.7%。另一项前瞻单臂Ⅱ期研究,纳入65例影像学诊断的NSCLC脑转移(≥5 mm)患者,对脑转移的最大数量或症状没有限制,患者按脑部病灶数量接受不同治疗方案:39例脑转移 1~3个的患者接受SRS 20~35 Gy/分1~5次完成+7 d内卡瑞利珠单抗+含铂双药化疗;24例脑转移≥4个的患者接受WBRT 30 Gy/分10次完成+7 d内卡瑞利珠单抗+含铂双药化疗;其余2例未接受放疗,主要研究终点6个月无进展生存率为71.7%(95% CI:58.8%~81.1%),次要终点中位PFS为10.7个月(95% CI:7.5~13.6个月),中位颅内PFS为16.0个月(95% CI:10.9个月~未达到),颅内和全身ORR均为81.5%,中位OS为17.6个月(95% CI:13.4~22.1个月);3~4级不良事件发生率为38.5%,整体安全性良好,可耐受。提示放疗联合免疫治疗方案具有良好的颅内抗肿瘤活性和耐受性。
约3%~9%的晚期NSCLC会发生脑膜转移,预后极差。目前放免联合治疗在NSCLC脑膜转移中的研究数据非常有限,一项回顾性研究分析了32例NSCLC脑膜转移,结果显示免疫治疗联合其他治疗(包括放疗)相比免疫单药治疗,展现出中位PFS(3和2个月)和中位OS(5.4和4个月)获益的趋势;免疫联合其他治疗组中,3例接受脑部放疗序贯免疫治疗的患者PFS长达20个月以上。对于可切除的脑转移(包括NSCLC和黑色素瘤),回顾性分析表明,术后放免联合治疗(SRS:18~22 Gy/1次完成,或27 Gy/分3次完成)可显著降低发生脑膜转移的概率(分别为22%和6%,P=0.007)。以上研究展现了放免联合对于治疗NSCLC脑膜转移的潜力,但亟需更高级别循证医学证据的验证。
临床问题 17
局限期小细胞肺癌(limited-stage small cell lung cancer, LS-SCLC)患者,是否推荐cCRT后序贯免疫巩固治疗?如何筛选免疫巩固治疗获益人群?免疫治疗启动的时间和治疗时长的考量?
共识意见:推荐LS-SCLC患者,cCRT后序贯使用免疫巩固治疗;无论患者临床分期、既往放射治疗频率、是否接受预防性脑照射(prophylactic cranialirradiation, PCI)等均可从免疫巩固治疗中获益。免疫治疗启动时间为1~42 d,治疗时长为2年(推荐等级:强,证据级别:1类证据)。
国际多中心随机对照Ⅲ期临床研究(ADRIATIC)显示,完成cCRT后未进展的LS-SCLC,分别接受度伐利尤单抗和安慰剂进行巩固治疗,中位OS为55.9和33.4个月(HR=0.73,95% CI:0.57~0.93,P=0.010 4),中位PFS为16.6和9.2个月(HR=0.76,95% CI:0.61~0.95,P=0.016 1);两组3/4级不良事件发生率相似,分别为24.3%和24.2%,度伐利尤单抗组免疫相关不良反应的发生率为31.9%,3/4级免疫相关不良反应的发生率为5.3%。提示LS-SCLC患者,cCRT后序贯使用免疫治疗显示出显著的疗效及良好的安全性和耐受性。且亚组分析显示,无论患者临床分期如何、既往放射治疗频率如何、是否接受 PCI 等,度伐利尤单抗均可带来一致的 OS 和 PFS 获益。该研究方案规定cCRT和按照当地的治疗标准接受了预防性全脑照射完成后需在1~42 d内启动免疫治疗,免疫治疗时长为2年;LS-SCLC患者cCRT后接受免疫巩固治疗的其他Ⅲ期研究也正在进行(NCT06095583,NCT05623267),期待结果公布。
临床问题 18
不耐受手术的T1~2N0期LS-SCLC患者,是否可以在放化疗的基础上联合免疫巩固治疗?
共识意见:对于不耐受手术的T1~2N0期LS-SCLC患者,推荐在标准放化疗的基础上应用免疫巩固治疗(推荐等级:强,证据级别:3类证据)。
不耐受手术的T1~2N0期SCLC患者的标准治疗为同步或序贯放化疗。多项探索放化疗±免疫治疗用于LS-SCLC的临床研究中均纳入部分不耐受手术的T1~2N0期患者。在评估cCRT+度伐利尤单抗对比cCRT治疗LS-SCLC的Ⅲ期临床研究ADRIAITC(n=530)中,分别入组了3.5%的Ⅰ期(T1N0及部分T2aN0期)和9%的Ⅱ期(部分T2bN0期)患者;亚组分析显示,放化疗+度伐利尤单对比单纯放化疗Ⅰ/Ⅱ期患者有获益趋势(PFS HR=0.71,95% CI:0.35~1.42,OS HR=0.92,95% CI:0.4~2.11)。
临床问题 19
LS-SCLC患者,化免诱导后序贯同步化放疗±免疫巩固的治疗模式是否可行?
共识意见:早期研究提示化免诱导后序贯同步化放疗±免疫巩固的治疗疗效和安全性良好,但有待更高级别循证医学证据验证,推荐LS-SCLC患者积极参与相关临床研究(推荐等级:强,证据级别:3类证据)。
LS-SCLC化放疗中免疫治疗介入时机是优化放疗联合免疫治疗策略的重要探索方向。对于肿瘤负荷较大患者,放疗时存在减小放疗靶区体积以降低放疗相关不良反应的临床需求,而先进行免疫+化疗诱导治疗,有望显著缩小肿瘤,降低肿瘤负荷,为放疗提供治疗基础。阿得贝利单抗联合cCRT治疗LS-SCLC的Ⅲ期临床研究中,患者首先接受2周期阿得贝利单抗+化疗诱导治疗,在第3周期时联用放疗,继续治疗2周期后接受阿得贝利单抗巩固治疗,研究在安全性导入阶段共纳入28例患者,中位PFS为17.9个月,中位OS尚未达到,2年总生存率为64.3%;27例患者(96.4%)出现≥3级治疗相关不良事件,其中发生率≥10%的不良事件均为血液学不良反应;4例(14.3%)患者发生治疗相关肺炎,均为2级。一项随机对照Ⅱ期研究纳入了40例LS-SCLC患者,试验组接受卡瑞利珠单抗联合化疗诱导治疗,随后进行cCRT及卡瑞利珠单抗巩固治疗,对照组接受标准放化疗,结果显示,联合免疫治疗组安全性可控,未明显增加不良反应(试验组和对照组3~4级治疗相关不良事件发生率为分别为58.8%和52.9%,3级肺炎发生率均为5.9%);疗效方面显示出初步的治疗疗效(试验组1年无进展生存率为54.5%,对照组为44.4%)。在LS-SCLC中探索化免诱导后序贯同步化放疗±免疫巩固的治疗模式的疗效和安全性的多项Ⅲ期研究正在进行中(NCT05353257,NCT04691063,NCT04624204,NCT03811002),化免诱导后序贯同步化放疗±免疫巩固的治疗疗效和安全性良好,但有待更高级别循证医学证据验证,推荐LS-SCLC患者积极参与相关临床研究。
临床问题 20
广泛期小细胞肺癌(extensive-stage small cell lung cancer, ES-SCLC)患者,化免系统治疗基础上联合胸部放疗的适用人群和时机?
共识意见:ES-SCLC患者在化免系统治疗有效的情况下,经MDT评估可联合使用胸部放疗,但缺乏高级别循证医学证据,有待进一步研究验证(推荐等级:强,证据级别:3类证据)。
1. 一线化免初始同步联合放疗证据:MATCH研究和LEAD研究均为多中心Ⅱ期研究,分别探索了阿替利珠单抗和度伐利尤单抗联合EP方案(依托泊苷及卡铂)化疗同步联合低剂量胸部放疗(15 Gy/分5次完成)一线治疗ES-SCLC的疗效和安全性,两项研究均选择了在化免联合第1个周期第1~5天进行同步低剂量放疗(15 Gy/分5次完成)。MACTH研究共纳入56例ES-SCLC患者,确认的ORR为87.5%,中位PFS为6.9个月(95% CI:5.4~9.3个月),12个月无进展生存率为27.7%,中位OS未达到,12个月总生存率为71.9%,整体安全性良好,仅观察到1例5级不良事件(感染性肺炎和肺栓塞)和 1例1级放射性肺炎。LEAD研究纳入30例患者, ORR为87.6%,中位PFS为8.3个月,12个月无进展生存率为40.00%,中位OS未达到,12个月总生存率为65.94%。整体安全性良好,1例患者发生2级间质性肺病。Ⅲ期临床研究TRIPLEX(NCT05223647)也正在探索于免疫+化疗诱导阶段介入放疗的效果,研究设计在诱导治疗的第2和第3周期期间,联合使用胸部放疗(30 Gy/分10次完成),诱导治疗完成后患者进入度伐利尤单抗维持阶段。期待Ⅲ期研究结果的公布为临床实践带来更多指导。
2. 一线化免联合放疗夹心证据:中南大学一项多中心单臂Ⅱ期试验结果显示,入组40例患者,化免诱导2周期后,第3周期联合大分割放疗(大分割放疗30~45 Gy/分10~15次完成),4周期化免治疗结束后进行阿替利珠单抗单药维持治疗,确认的ORR为72.7%,中位PFS为8.6个月,12个月时的无进展生存率为27.5%;整体安全性可耐受,3~4级治疗期间的不良事件发生率为22.5%,未观察到5级不良事件。
3. 免疫维持阶段联合胸部放疗证据:ES-SCLC-1st-IIT-SHR1316-CRT研究提示,一线免疫联合化疗后免疫单药维持阶段联合胸部放疗可明显提升患者的PFS和OS。入组患者67例患者接受阿得贝利单抗+EP(依托泊苷联合顺铂)/EC(依托泊苷联合卡铂)治疗,未进展者接受阿得贝利单抗加胸部放疗(≥3 Gy每次,共10次或≥2 Gy每次,共25次),随后进行阿得贝利单抗维持治疗。其中45例患者按计划接受了序贯放疗,患者的OS为21.4个月,PFS为10.1个月,ORR为71.6%(48/67)。3级及以上肺炎发生率为6%(4/67),未出现与治疗相关的死亡。RAPTOR是一项正在进行中的探索在免疫+化疗基础上,免疫单药维持阶段联合胸部放疗治疗一线ES-SCLC疗效和安全性的Ⅲ期临床研究(NCT4402788),纳入阿替利珠单抗+化疗治疗4~6周期后未进展的ES-SCLC患者,试验组接受阿替利珠单抗联合胸部放疗,对照组仅接受阿替利珠单抗治疗,目前研究正在进行中,期待结果早日公布。
在免疫治疗时代,放疗与免疫治疗联合可能会增加不良反应,特别是肺炎。目前基于有限的临床数据,难以确定ES-SCLC的适当放疗剂量。对于预计生存时间长且状态良好的患者,较高剂量的放疗可能会带来更好的局部控制和总体生存率,但需谨慎避免严重不良反应。
临床问题 21
化免系统治疗基础上,不同分期患者联合PCI治疗的价值?
共识意见:LS-SCLC患者推荐在化免系统治疗基础上联合PCI;ES-SCLC患者PCI应用的价值有待进一步验证(推荐等级:强,证据级别:LS-SCLC 1类证据,ES-SCLC 3类证据)。
1. LS-SCLC:Ⅲ期临床研究ADRIATIC结果数据亚组分析显示,度伐利尤单抗组接受PCI对比未接受PCI,OS:未达到和37.3个月,PFS:28.2和9.1个月;安慰剂组接受PCI对比未接受PCI,中位OS为42.5和24.1个月,PFS为13.0和7.4个月。无论在度伐利尤单抗组或安慰剂组,PCI均能提升患者的生存获益。
2. ES-SCLC:对于化免联合治疗有效的患者,应进行脑部MRI复查,以决定是否进行PCI或仅进行MRI监测。对同时进行的化疗免疫疗法有反应、没有脑转移且一般状况良好的患者,应考虑进行PCI。推荐PCI剂量为25 Gy分10次给予,20 Gy分5次是另一种选择。目前对于接受免疫治疗的患者使用PCI的证据有限,在IMpower133试验中,完成同步化疗免疫治疗后,10.9%的患者接受了PCI,不良事件并未明显增加。
临床问题 22
放疗联合免疫治疗的安全性特征如何?放疗联合免疫是否产生额外的或更严重的安全性事件?
共识意见:免疫联合放疗在肺癌患者中整体安全可控,联合治疗并未增加整体安全性风险。但部分不良反应与放疗的不良反应重合,可能会导致不良反应的叠加,需要引起临床医师的足够重视(推荐等级:强,证据级别:1类证据)。
多项荟萃分析显示放疗联合免疫治疗的总体不良反应发生率较高(95.5%),但并未增加整体安全性风险且大多数不良反应为1~2级。常见的任意级别不良事件分别为疲劳(49.7%)、咳嗽(43.3%)、呼吸困难(34.1%)、肺炎(23%)、恶心(29.1%)、腹泻(15.8%)、皮疹(13.4%)、皮炎(11.2%)、瘙痒(12.4%)和甲状腺炎(9.4%)。≥3级不良事件总体发生率为30%左右,其中肺炎是最常见的高级别不良反应(3.8%)和5级不良反应(0.6%)。虽然心脏不良反应发生率较低(0~5%),3~5级不良反应为0~2.7%,但死亡率高。呼吸系统和心脏不良反应是需要临床医师警惕的致死性不良反应。PACIFIC研究及GEMSTONE-301研究显示,对于Ⅲ期不可切除NSCLC,同步或序贯放化疗后,免疫维持组3~4级不良反应发生率及因不良反应导致治疗中断率均高于对照组。在晚期NSCLC中,免疫联合放疗的短期安全性似乎可以接受,免疫或放疗相关不良事件无显著增加。ADRIATIC研究显示,在LS-SCLC中,cCRT后序贯度伐利尤单抗相较于安慰剂组,其不良事件总体发生率、3~4级全因不良事件发生率均基本相当,两组各级别肺炎/放射性肺炎及3~4级肺炎/放射性肺炎发生率相近。在放疗的剂量和分割方面,Welsh等进行的探索性分析发现,对于转移性NSCLC患者,SBRT组(50 Gy/分4次完成)和传统放疗组(45 Gy/分15次完成)不良反应发生率差异并无统计学意义,但SBRT组高级别不良反应发生率更低。
临床问题 23
接受放免联合治疗的患者需要进行哪些安全性评估?
共识意见:对于局部晚期NSCLC、晚期NSCLC及SCLC,治疗的主要手段及治疗的主要目的不同,安全性评估需结合具体情况进行选择(推荐等级:强,证据级别:2类证据)。
研究显示,当联合胸部放疗时,PD-1和PD-L1抑制剂之间没有显著差异。而与PD-1或PD-L1单药治疗相比,放疗联合PD-1或PD-L1抑制剂与较高的肺炎发生率相关。虽然ICI与胸部放疗均参与了肺炎的发生和发展,但是胸部放疗主导了DNA损伤、随后的炎症反应和正常肺组织的纤维化,放免联合治疗中,放疗可能是肺炎发生及发展的主要诱导因素。因此,在治疗前,应根据治疗的疾病分期,治疗的主要手段及治疗的主要目的进行安全性评估及治疗策略的取舍。既往研究显示,年龄、吸烟状态、自身免疫性疾病及合并肺基础疾病(慢性阻塞性肺疾病/间质性肺疾病/肺气肿等)与放疗或免疫治疗或放免联合治疗所致肺不良反应的发生密切相关,在治疗前应予以常规评估。与放疗密切相关的风险因素包括肿瘤体积,放疗技术,放疗剂量和分次,放疗剂量学参数等。在免疫治疗时代,应更加严格控制肺的照射剂量限制,确保联合治疗的安全性。与免疫治疗密切相关的风险因素包括PD-L1的表达、免疫药物种类、免疫药物联合治疗方式、放疗免疫联合方式、结合的时机等。在实际临床工作中,应谨慎制定治疗策略,并在放疗免疫联合治疗期间注意密切关注肺不良反应。
临床问题 24
同步对比序贯放免联合模式对安全性的影响?
共识意见:目前没有充足的循证医学证据对比同步对比序贯放疗联合免疫安全性。非头对头数据显示同步放免联合的治疗模式不良事件发生率更高,远期不良反应的发生有待进一步研究(推荐等级:强,证据级别:2类证据)。
由于放疗在正常组织中诱导的时间依赖性效应,其不良反应覆盖从急性炎症效应到慢性纤维化不良反应。因此,放疗同步或序贯免疫治疗可能会引起不同的不良反应,尤其是在肺组织。一项荟萃分析显示,在所有级别的不良事件,疲劳在两组中最为常见,但两组之间无显著差异;与接受序贯治疗的患者相比,接受同步治疗的患者所有级别的肺炎发生率略高,但这种差异无统计学意义(分别为25.8%和21.3%,P=0.66);其他呼吸系统不良事件(包括咳嗽和呼吸困难)的发生率同步治疗组也较高;高级别不良反应和肺炎的发生率放免同步治疗组也更高,但差异无统计学意义。PACIFIC研究中放疗序贯免疫3/4级的不良反应发生率为29.9%,最常见的3/4级不良反应为肺炎,发生率4.4%,因为不良反应而停用研究药物的患者占15.4%。而在PACIFIC-2研究中放疗同步免疫治疗,3/4级不良反应发生率为53.4%,≥3级肺炎发生率4.6%,因为不良反应而停用研究药物的患者占25.6%,在数值上高于PACIFIC研究。同时,我们也看到PACIFIC-2研究中纳入了一部分高龄患者,这部分患者对安全性数据也会产生一定的影响。但是免疫治疗可能在放射治疗结束后多年再次诱导放射治疗相关性肺炎,PACIFIC-2研究在不要求记录 12和 18 个月至疾病进展的疗效情况下,仍然可以观察到不良事件导致的死亡率存在差异(分别为4.6%和0.9%)。因此序贯治疗并不能完全避免重叠不良反应,远期不良反应的发生及机制有待进一步研究。
临床问题 25
接受胸部放疗(常规分割或大分割)联合免疫治疗的患者,需要关注哪些安全性风险?如何鉴别与处理?(心脏不良反应,肺不良反应,放射性肺炎和免疫肺炎的鉴别处理)
共识意见:免疫联合放疗在肺癌患者中整体安全可控,是否会增加额外或严重不良反应尚无统一定论,呼吸系统和心脏不良反应是需要临床医师重点关注的不良反应。为了预防或尽早发现不良事件,应在治疗前进行详细的患者基线状况评估,治疗中优化靶区范围和放疗计划评估,降低对正常组织的损伤,并加强随访观察。若发生不良反应后尽快完善鉴别诊断,及时对症施治,减少不良反应的影响(推荐等级:强,证据级别:2类证据)。
放疗联合免疫治疗时需关注心脏和肺相关的安全性风险。虽然心脏不良反应发生率较低(0~5%),3~5级不良反应为0~2.7%,但死亡率高。在放化疗联合ICI的临床实践中,要密切监测不良反应相关症状的发生,特别是对于年老、体力差以及患有肺基础疾病的患者。
1. 肺损伤:放射性肺损伤(radiation induced lung injury, RILI)是指胸部肿瘤患者由于放射线对正常肺组织造成的损伤,可能表现为炎症反应,发生率为5%~15%。免疫治疗相关性肺炎(checkpoint inhibitor pneumonitis, CIP)是一种由ICI引起的临床、影像和病理表现各异的肺损伤,临床表现形式多样,总发生率约为2%~5%,总死亡率10%~17%。相较于单独放疗和免疫治疗,联合治疗可明显提高疗效,但同时也增加了肺炎的发生率。根据放疗与免疫的时序不同,免疫药物的种类不同(单免疫抑制剂或双免疫抑制剂),所有级别肺炎发生率为20%~44.2%,3级或以上肺炎发生率为3%~17.6%。
2. RILI和CIP的鉴别诊断:RILI与CIP的临床症状相似,主要表现为咳嗽、咳痰和呼吸困难。鉴别放射-免疫相关性肺炎对于其治疗至关重要。(1)在发病时机上,RILI多在放疗后6个月内出现,尤其在放疗后1~3个月内较为常见,而CIP可能在治疗后2~24个月内的任何时间发生。(2)影像学上,RILI通常局限于放射区域内,表现为渗出、实变和纤维化;CIP的影像学表现则更为多样,可分为5种类型:隐源性组织性肺炎、磨砂玻璃样结节的磨玻璃样混浊、小叶间隔增厚的间质性肺炎、小叶中心结节的超敏反应性肺炎,以及未明确定义的肺炎。临床上,RILI和CIP的鉴别常依据病变位置,RILI多见于照射的高剂量区域,与放疗剂量参数紧密相关,而CIP则多见于高剂量区域之外。(3)在临床实践中,除了明确放射-免疫相关性肺炎的性质,还需与其他可能引起相似症状的疾病进行鉴别诊断。RILI和CIP均为无菌性炎症,与感染性疾病相比,通常不伴有发热和白细胞升高等典型感染症状。感染性肺炎的影像学表现早期为毛玻璃样阴影,细菌性肺炎多局限于肺叶或肺段,而病不良反应肺炎则表现为多发毛玻璃样阴影。(4)此外,还需注意与肿瘤进展的鉴别,后者常表现为咳嗽、咯血、胸痛、体重减轻、呼吸困难,肿瘤标志物可能升高,影像学上可见肺癌原发灶增大及新的结节状影、片状影、毛玻璃影等。
因此,放射-免疫相关性肺炎的诊断需要综合考虑患者的放疗和ICI使用史、临床症状、发病时间、影像学表现、实验室检查,并排除其他可能引起类似表现的疾病,治疗方案可以参考指南或共识。
3. 心脏损伤:放射性心脏病(radiation-induced heart disease, RIHD)是指由于放射治疗导致的心脏及其血管系统的损伤,可以表现为多种心脏疾病,其中心包疾病、卒中、心律失常、急性冠脉综合征和心力衰竭,其发生率分别为3.6%~8%、6.3%、10.7%~15.7%、5.7%和8.6%。ICI通过激活免疫系统对抗肿瘤,同时也可能影响心脏,导致免疫相关性心脏病,其中心肌炎、心力衰竭和心包积液的发生率分别为0.72%、0.15%和0.15%。
RIHD的发生率受多种因素影响,包括放疗的剂量、心脏受照射的体积、患者的年龄、性别、以及是否存在其他心脏病风险因素等。肺癌患者中有高达25%合并有心血管疾病,属于RIHD高危人群,需要特别关注。一项放免联合的回顾性研究纳入了194例接受ICI治疗的Ⅲ~Ⅳ期肺癌患者,其中107例(55.2%)患者同时接受了中位剂量为60.4 Gy(范围15~75 Gy)的胸部放疗,有13例(12.2%)观察到非ST段抬高型心肌梗死和新发室上性心动过速等心脏不良反应。
放疗后的心脏损伤重在预防,RIHD的一级预防措施主要针对模拟定位、勾画靶区、制定放疗计划和实施放疗步骤进行优化;损伤发生后须对症使用心血管治疗药物。
免疫相关心脏不良反应的处理原则如下。由于ICI相关心肌炎可能导致危及生命的恶性心律失常或合并心力衰竭的暴发性心肌炎,建议所有可疑或确诊的所有级别心肌炎患者均暂停ICI治疗,并启动肿瘤心脏病团队多学科会诊制定个体化治疗方案。≥2级的心脏不良反应停用ICI同时尽早启动高剂量糖皮质激素治疗,加强心脏症状管理,激素难治性患者必要时加用免疫抑制剂,3/4级则需永久停用ICI,重症监护,生命支持。尽早使用糖皮质激素是ICI相关心肌炎治疗成功的关键,可降低主要心血管不良事件发生率并改善预后。在出现3/4级心脏相关不良反应时,Ⅰ级推荐中详细描述激素治疗策略:立即给予甲泼尼龙冲击治疗500~1 000 mg/d,持续3 d,心功能恢复至基线后改为甲泼尼龙1 mg/(kg·d),此后缓慢减量至少4~6周后停药(必要时6~8周)。严重心肌炎患者如果糖皮质激素治疗24 h无缓解,应尽早考虑使用免疫抑制剂(如英夫利昔单抗、他克莫司或霉酚酸酯)、抗胸腺细胞球蛋白、免疫球蛋白和血浆置换,可降低重症患者死亡风险,中重度合并心力衰竭者避免使用英夫利昔单抗。由于潜在暴发性和致死性可能,ICI相关心脏不良反应恢复后能否重启ICI仍有争议,需结合不良反应级别、ICI疗效和是否有合适替代方案等因素综合权衡。其中,3/4级出现显著传导异常或室性心律失常者不建议重启免疫治疗,1/2级能否ICI再挑战仍有待于更多循证医学证据。
临床问题 26
接受脑部放疗(SRS或WBRT)联合免疫治疗的患者,需要关注哪些安全性风险?如何鉴别与处理?(神经不良反应)
共识意见:放疗联合ICI可通过多种机制对脑转移病灶产生协同作用,联合治疗手段的疗效和安全性已经被较多项回顾性研究认可,目前尚无循证医学证据证明脑部放疗联合免疫治疗会产生额外的或更严重的安全性事件(推荐等级:强,证据级别:3类证据)。
脑转移在肺癌患者中发生率很高,约20%~30%初诊肺癌患者伴有脑转移,70%~80%肺癌患者最终会发生脑转移,一旦出现脑转移会严重影响了肺癌患者生存率及生存质量。PCI成为LS-SCLC标准治疗中的一部分,然而,全脑放疗也会造成的不可逆的神经认知功能下降,其发生率为30%。海马保护的PCI联合神经保护药物(盐酸美金刚)可以减少患者的认知功能障碍的发生。
放疗联合免疫治疗脑转移的不良事件报道较少,多数研究显示两者联合治疗不会增加患者放射性脑坏死、中枢神经系统相关不良事件和免疫相关不良事件的发生率。在大多数研究中,≥4级的不良事件发生极为罕见,在涉及842例患者的22项研究中多报道为轻度至中度不良事件(1~3级)。
WBRT作为针对脑转移的传统放疗方式,Liao等回顾性分析了70例NSCLC脑转移(NSCLC-BM)患者,结果表明,PD-1抑制剂联合WBRT较单纯WBRT不增加不良反应(OR=0.94,P=0.879)。Hubbeling等对163例NSCLC-BM患者的安全性分析表明,与单独放疗相比,放疗(WBRT/部分脑放疗/SRS)联合ICI治疗NSCLC-BM是安全的,常见的不良事件为乏力(76%)、放射性皮炎(48%)、WBRT相关认知障碍(41%)和SRS相关头痛(26%),其中绝大多数都是1~2级不良事件。
SRS联合ICI在改善预后或局部控制方面优于单纯放疗,是否增加放射性不良反应的风险尚无定论,缺乏随机对照研究进一步验证。对于脑转移患者,单独放疗的放射性脑坏死发生率相对较低,但使用SRS方法时较高。在仅针对 SRS 或分次 SRS 的研究中,报告的放射性坏死发生率分别为0~20%和1%~8%;对于仅WBRT,研究表明放射性坏死发生率为0~1.6%;对于SRS联合WBRT治疗,放射性坏死发生率为0~5.6%。Shepard等回顾性匹配队列研究显示,与单独ICI相比,SRS联合ICI不仅能更有效地促进NSCLC-BM病灶的消退,而且具有良好的安全性,并未显著增加放射性坏死或瘤内出血风险(P=0.99)、瘤周水肿进展率(P=0.162)。Martin等研究却发现SRS-ICI联合治疗较单纯SRS与放射性坏死的发生率显著相关(HR=2.56,P=0.004),但这项研究混杂了较多黑色素瘤和肾细胞癌来源脑转移的患者。
肺癌无疑是危及我国公民健康和生命最严重的恶性肿瘤,近年来ICI的应用给肺癌的治疗带来了新的曙光,如何将ICI与放疗联合使用是当前临床关注的热点。可喜的是,基于放疗诱导的原位疫苗效应、增强抗原提呈、重塑肿瘤微环境等多种机制的阐明,多项临床研究结果也已初步证实了ICI与放疗联合使用的巨大治疗潜力。值得我们后续开展一系列更有针对性的研究,用更大的样本、更高级别的循证医学证据夯实和延伸目前已有临床探索的结论。同时我们也必须清醒地认识到,两种治疗手段的联合使用往往会带来呼吸、心血管等系统的损伤,因此,我们不仅要准确地判断和及时地治疗损伤,而且在治疗前规范、充分的MDT讨论尤其不可缺少。此外,根据本专家共识,不同期别的肺癌患者均有接受ICI联合放疗治疗的可能,那么如何选择联合模式,筛选出不良反应最小、疗效最佳的获益人群仍是需要我们持续探索的重要课题。
参考文献略。
编写委员会成员名单
指导专家
赫捷(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院胸外科/中国医学科学院肿瘤医院山西医院)
于金明(山东第一医科大学附属肿瘤医院胸部放疗科)
专家组组长
王洁(国家癌症中心/国家肿瘤临床医学中心/中国医学科学院北京协和医学院肿瘤医院内科/中国医学科学院肿瘤医院山西医院)
特邀顾问
孔凤鸣(香港大学深圳医院胸部肿瘤科)
专家组副组长
程颖(吉林省肿瘤医院胸部肿瘤内科)
宋启斌(武汉大学人民医院肿瘤中心)
袁双虎(中国科技大学附属第一医院安徽省肿瘤医院放疗科)
专家组成员(按姓氏汉语拼音字母排序)
毕楠(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院放射治疗科)
蔡旭伟(上海市胸科医院上海交通大学医学院附属胸科医院放疗科)
陈大卫(山东第一医科大学附属肿瘤医院放射免疫与分子影像研究室)
陈龙(广西医科大学附属肿瘤医院放疗科)
褚倩(华中科技大学同济医学院附属同济医院肿瘤科)
崔久嵬(吉林大学第一医院肿瘤科)
董晓荣(华中科技大学同济医学院附属协和医院肿瘤科)
段建春(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科/中国医学科学院肿瘤医院山西医院内科)
樊旼(复旦大学附属肿瘤医院放疗科)
方文峰(中山大学肿瘤医院内科)
冯正富(广州医科大学附属清远医院清远市人民医院肿瘤放疗科)
葛红(郑州大学附属肿瘤医院河南省肿瘤医院放射治疗中心)
顾涛(秦皇岛市第一医院放疗科)
郭卉(西安交通大学第二附属医院肿瘤内科)
郭杰(吉林大学第二医院放疗科)
黄媚娟(四川大学华西医院胸部肿瘤科)
李建成(福建省肿瘤医院放射治疗科)
李子明(上海市胸科医院上海交通大学医学院附属胸科医院肿瘤科)
刘安文(南昌大学第二附属医院肿瘤内科)
刘慧(中山大学肿瘤防治中心放疗科)
柳影(吉林省肿瘤医院胸部肿瘤内科)
骆志国(十堰市太和医院肿瘤科)
潘燚(广东省人民医院放疗科)
蒲兴祥(湖南省肿瘤医院肺胃肠内科)
钱东(中国科技大学附属第一医院安徽省肿瘤医院放疗科)
任胜祥(同济大学附属上海市肺科医院肿瘤科)
沈波(江苏省肿瘤医院南京医科大学附属肿瘤医院肿瘤内科)
石安辉(北京大学肿瘤医院肿瘤放射科)
谭锋维(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院胸外科)
王军(河北医科大学第四医院放疗科)
王琳琳(山东第一医科大学附属肿瘤医院胸部放疗科)
邬麟(湖南省肿瘤医院胸部内二科)
许斌(武汉大学人民医院肿瘤中心)
杨弘(中山大学肿瘤防治中心胸外科)
姚颐(武汉大学人民医院肿瘤中心)
姚煜(西安交通大学第一附属医院肿瘤内科)
曾珊(中南大学湘雅医院肿瘤科)
仲佳(国家癌症中心国家/肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科)
张力元(苏州大学附属第二医院放射治疗科)
张绪超(广东省人民医院肺癌研究所中心实验室)
赵化荣(新疆医科大学第一附属医院放疗科)
赵路军(天津市肿瘤医院放射治疗肿瘤科)
周承志(广州医科大学附属第一医院呼吸与危重症医学科)
周清(广东省人民医院肿瘤内科)
执笔人
毕楠(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院放射治疗科)
陈大卫(山东第一医科大学附属肿瘤医院胸部放疗科)
段建春(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科/中国医学科学院肿瘤医院山西医院内科)
方文峰(中山大学肿瘤医院内科)
郭杰(吉林大学第二医院放疗科)
李子明(上海市胸科医院上海交通大学医学院附属胸科医院肿瘤科)
柳影(吉林省肿瘤医院胸部肿瘤内科)
钱东(中国科技大学附属第一医院安徽省肿瘤医院放疗科)
谭锋维(国家癌症中心国家/肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院胸外科)
王琳琳(山东第一医科大学附属肿瘤医院胸部放疗科)
许斌(武汉大学人民医院肿瘤中心)
姚颐(武汉大学人民医院肿瘤中心)
仲佳(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科)
周清(广东省人民医院肿瘤内科)