孙嘉阳 1,胡威 2,唐玉 3*
(1. 遵义医科大学,贵州遵义 563006;2. 遵义医科大学附属医院肿瘤科,遵义医科大学附属医院早期临床研究病房,贵州遵义 563000;3. 国家癌症中心 / 国家肿瘤临床医学研究中心 / 中国医学科学院北京协和医学院肿瘤医院药物临床试验研究中心,北京 100021)
摘要
目的:总结 2020—2024 年 6 月全球肝癌药物注册临床试验开展情况及发展趋势。
方法:基于英国 Informa 公司旗下的 Pharma Intelligence 开发的 Trialtrove 数据库,提取 2020—2024 年全球范围启动的肝癌药物临床试验及涉及试验药物的相关信息,分析肝癌临床研究的年度增长情况、试验、药物特征及其相关因素。
结果:研究统计时间段内,全球共开展了 356 个肝癌药物注册临床试验,占全部肿瘤治疗药物临床试验的 4.3%,其中由国内企业发起 189 个(53.1%)。肝癌临床试验启动数量在 2022 年达到顶峰(101 个)。在试验分期方面,Ⅰ期临床试验(含Ⅰ、Ⅱ期)是最常见的临床试验分期类型(266 个,74.7%);在试验适应证方面,针对晚期肝癌的药物研发所占的比例最高(324 个,91.0%)。在所有试验药物中,所涉及的药物类型主要包括抗体类药物(48.0%)、小分子靶向药物(25.4%)、细胞基因类药物(15.4%)和抗体耦联药物(5.0%)。32 个临床试验针对初治的不可手术或局部治疗的晚期肝癌的临床试验中,探索的主要试验性治疗方式是以免疫检查点抑制剂治疗为基础的药物联合治疗;针对晚期≥ 2 线治疗患者开展的药物临床试验共 262 个,其中 32 个(12.2%)在免疫治疗失败的晚期肝癌患者中开展,目前均处于Ⅰ、Ⅱ期试验阶段,涉及的试验药物类型较为多样。
结论:全球肝癌药物临床开发较为活跃,国内企业研发药物在其中发挥重要作用。在肝癌中,免疫治疗是最为活跃的药物研发领域;在后线肝癌临床试验中 , 细胞基因治疗也是重要的临床研究领域。建议国内企业加大针对肝癌新药研发投入,挖掘更多新靶点和新机制作用药物,拓宽肝癌治疗的可能方向。
关键词:肝癌;药物;临床试验;免疫治疗;细胞基因治疗
肝癌是世界上第六大最常见的癌症,也是癌症死亡的第三大常见原因 [1]。其发病率在全球范围内不断增长,是全球性的健康挑战。肝细胞癌(hepatocellular carcinoma, HCC)是最常见的肝癌形式,约占肝癌病例总数的 90%[2]。大部分 HCC 一旦发现即进入中晚期,发病例和致死率较高,5 年总生存(overall survival,OS)率仅为 18%,使之成为仅次于胰腺癌的第二大致命肿瘤。
近年来,在国内外专家学者的共同努力下,HCC的临床治疗已经发生了显著变革,临床试验取得了一系列成果,涌现了多种新的治疗方法和药物,极大地提升了治疗效果 [3]。程序性死亡受体 1(programmed death-1,PD-1)抑制剂阿替利珠单抗联合贝伐珠单抗疗法作为 10 余年来首个改善晚期 HCC 患者 OS 时间和无进展生存(progress-free survival, PFS)时间的治疗方案,于 2020 年 5 月被美国食品药品监督管理局批准用于未接受过全身治疗的无法切除的 HCC 患者 [4]。2020年 10 月,中国国家药品监督管理局(National MedicalProducts Administration, NMPA)也批准这一组合疗法上市,使得 HCC 的治疗正式迈入联合免疫治疗时代。随后,阿帕替尼联合卡瑞利珠单抗(“双艾”方案)、信迪利单抗联合贝伐珠单抗生物类似物(简称“双达”方案)等靶免联合方案均获得 NMPA 批准上市,并被《中国临床肿瘤学会原发性肝癌诊疗指南》纳入Ⅰ级推荐(Ⅰ A 类证据)[5]。除了系统治疗的迅猛发展,局部治疗也取得长足进步。2023 年 6 月,“双艾”方案联合经导管动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)治疗 HCC 的全国多中心、回顾性队列研究 CHANCE2211 结果发表,显示靶向治疗与免疫治疗(简称靶免)联合治疗组的中位 OS、PFS 时间和客观缓解率(overall response rate, ORR)均显著优于 TACE 单纯治疗组 [6],为局部晚期 HCC 治疗提供更多选择。
尽管HCC疗效在免疫治疗时代获得了长足的进步,其 OS 和 ORR 仍不尽如人意。多数大规模靶免联合治疗晚期 HCC 的临床试验所报道的 ORR 在 25%~30% 之间,部分小规模临床试验甚至达到接近 40%,意味着>50% 患者接受靶免联合治疗后,未能出现显著的缓解 [7]。而在 1 线靶免联合治疗失败的晚期 HCC 患者中,更是缺乏有效的治疗手段,为临床诊疗提出了挑战 [8]。
为此,本研究旨在对 2020—2024 年全球启动的HCC 注册临床试验进展进行回顾与总结,分析当前HCC 临床试验格局,为下一步的研发方向提供参考。
1 资料与方法
1.1 资料来源与提取 本研究基于英国 Informa 公司旗下 Pharma Intelligence 开发的 Trialtrove 数据库。该数据库为全球药企公认的临床试验信息汇聚平台 [9]。笔者采用 [(Disease is Oncology: Liver) AND (Actual Start Date is from 2020/01/01 to 2024/6/30) AND (Sponsor Type is only Industry)] 搜索策略,选取 2020 年 1 月 1 日至 2024年 6 月 30 日,由企业发起的,适应证中包含 HCC 的临床试验,共计 389 个。人工复核后,去除其中以治疗贫血为目的的试验 1 个、健康人中开展的生物等效性试验或食物药物相互作用研究 32 个,最终 356 个临床试验纳入分析。
1.2 评价指标 主要评价指标包括不同类别 HCC 药物临床试验数量、临床试验占比、HCC 试验药物数量种类。
1.3 统计学方法 采用 SPSS 统计学软件进行统计学分析。率的比较和趋势分析采用 χ2 检验。P<0.05 为差异有统计学意义。计量资料用均数 ± 标准差表示,计数资料用频数或百分比或率表示。
2 结 果
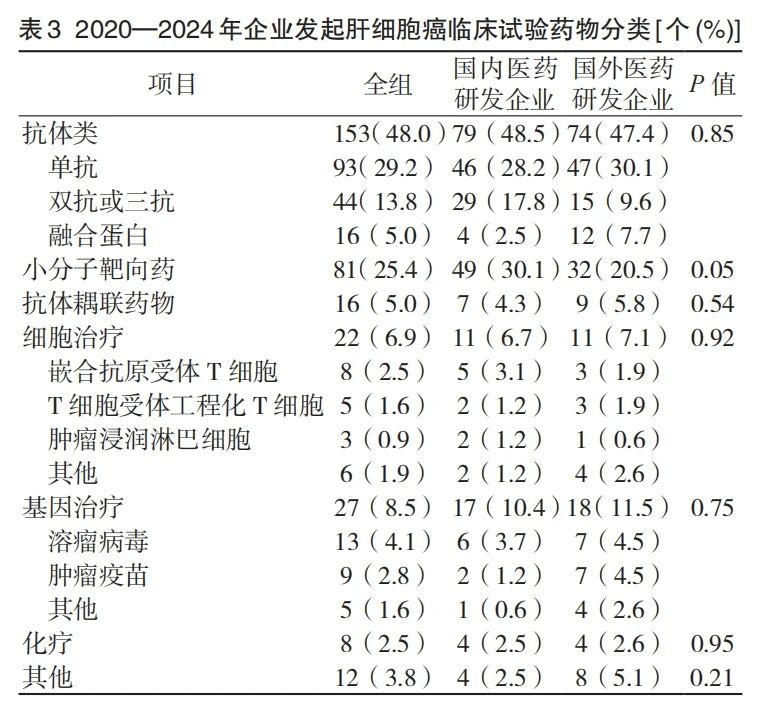
2.1 HCC 全球药物临床试验概况 研究纳入的 356 个药物注册临床试验占同期全部肿瘤药物注册临床试验的4.3%(356/8 218),其基本特征参见表 1。如表 1 所示,在所开展的临床试验中,国际多中心临床试验共 115 个,占全部试验的 32.3%,其中 78.3%(90 个)由国际医药研发企业发起,远高于国内医药研发企业发起的国际多中心试验数量(P<0.001)。Ⅰ期临床试验(含Ⅰ、Ⅱ期)是最常见的临床试验分期类型,共 266 个,占全部试验的 74.7%。国内医药研发企业发起的Ⅰ期(含Ⅰ、Ⅱ期)临床试验占其开展全部试验的 77.2%(146 个),显著高于国外医药研发企业(120 个,71.9%,P=0.006)。
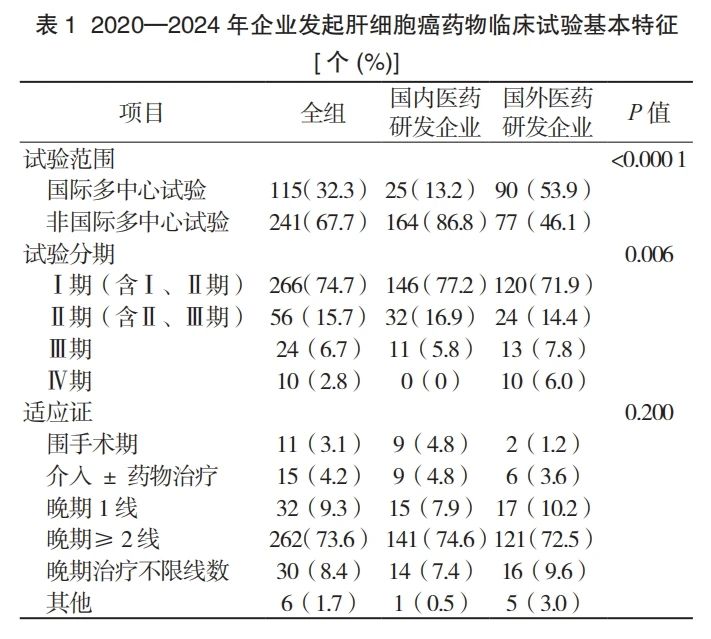
由国内医药研发企业发起的试验共 189 个,占全部 HCC 启动试验的 53.1%,占全部国内医药研发企业发起的抗肿瘤试验的 5.1%(189/3 692)。2020—2024 年间,HCC 临床试验启动数量在 2022 年达到了顶峰,为 101 个,随后逐步下降,2023 年全年启动试验数量与 2020 年基本持平。由国内企业发起的临床试验数量呈现类似的变化趋势,其占全球 HCC 药物临床试验的比例也在 2022 年达到最高(62.4%)(图 1)。
在 356 个临床试验中,215 个(60.4%)临床试验在中国开展,162 个(45.5%)仅在中国大陆地区进行。仅在中国大陆开展的临床试验中,94.4%(153/162)由国内医药研发企业发起。
在试验适应证方面,针对晚期 HCC 的药物研发所占的比例最高,324 个临床试验在这一人群中开展,占比 91.0%。其中针对晚期≥ 2 线治疗患者开展的药物临床试验共 262 个,占比 73.6%。国内外医药研发企业在1 线及后线临床试验的占比方面相近(P=0.20)。所有只涉及药物治疗的临床试验中,158 个(48.8%)仅涉及 1 个临床试验药物,其余 166 个(51.2%)则为多药联合临床试验。
除单纯药物治疗外,32 个试验涉及全身药物与其他治疗手段的结合,其中 15 个(4.5%)探索 TACE 联合药物治疗、11 个(3.1%)探索围手术期治疗、4 个探索肝动脉灌注化疗联合药物治疗、1 个探索射频消融联合德瓦鲁单抗及曲美木单抗治疗、1 个单臂研究评估在存在大血管受侵的 HCC 中立体定向放疗后阿替利珠单抗联合贝伐珠单抗巩固治疗的疗效。
2.2 临床试验涉及药物 全部临床试验共涉及药物319 个,其中 163 个(51.5%)药物由国内医药研发企业研发。43 个(13.5%)为全球已批准的上市药物,22 个(6.9%)已在中国上市。43 个上市药物中,仅 8个有 HCC 适应证(表 2)。

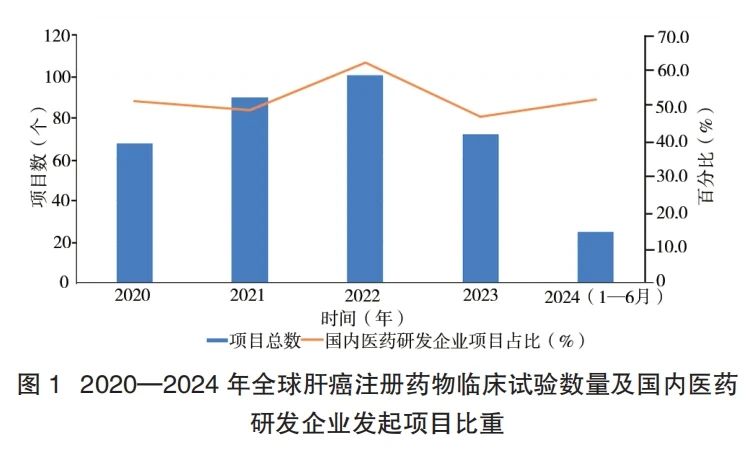
在所有试验药物中,抗体类药物是最常见的药物类型,占全部药物的 48.0%;其中 60.8%(93/153)为单克隆抗体,28.8%(44/153)为双抗或多抗类药物,常见研发靶点参见图 2。
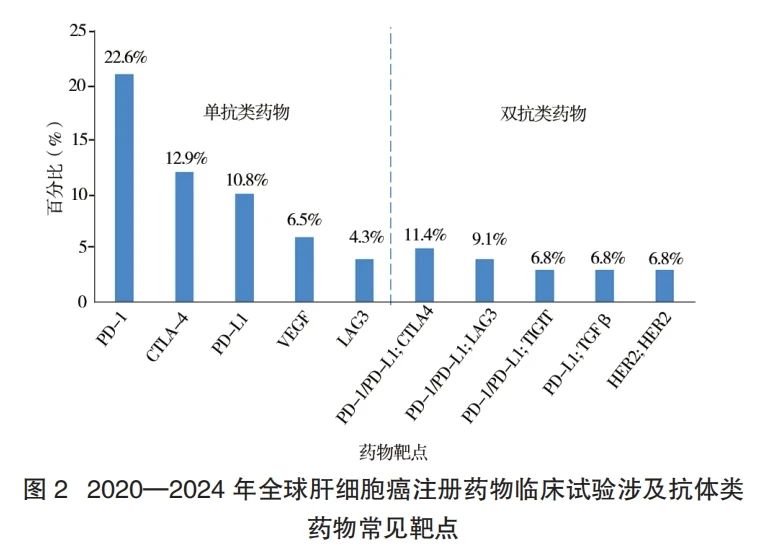
小分子靶向药物占全部试验药物的 25.4%,最常见的是具有血管生成抑制作用的多靶点抑制剂,共计 24个,占全部小分子靶向药的 29.6%。细胞基因类药物共计 51 个,占全部试验药物的 15.4%,均处于Ⅰ、Ⅱ期临床试验阶段。嵌合抗原受体 T 细胞(chimeric antigen receptor T-cell,CART)是细胞治疗中最常见的类型,共 8 个,其中 6 个均针对磷脂球蛋白聚糖 3(phospholipid globulin glycan 3,GPC3)靶点,1 个同时靶向 GPC3和白细胞介素 18,1 个靶向癌胚抗原。溶瘤病毒则是基因治疗中最常见的药物类型,共 13 个。处于研发阶段的抗体耦联药物(antibody-drug conjugate,ADC)则共有 16 个(5.0%),开展临床试验 18 个。最常见的作用靶点包括 B7-H3(3 个)、Trop2(2 个)和人表皮生长因子受体 2(human epidermal growth factor receptor 2)(2 个)。国内医药研发企业开发的小分子靶向药物数量及比例高于国外医药研发企业(P< 0.05),其他的研发药物的国内外研发比例无统计学差异(表 3)。
2.3 晚期 HCC 临床试验开展情况 针对初治的不可手术或局部治疗的晚期 HCC,共开展了 32 个临床试验。其中Ⅰ期(含Ⅰ、Ⅱ期)临床试验 8 个(25%),Ⅱ期(含Ⅱ、Ⅲ期)11 个(34.4%),Ⅲ期 11 个(34.4%),Ⅳ期 4 个(12.5%)。在Ⅰ ~ Ⅲ期研究中,除 2 个放射性药物、1 个中成药、1 个 T 细胞疫苗和 1 个化疗药物(西罗莫司白蛋白结合型纳米颗粒)外,24 个均为以免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)治疗为基础的药物联合免疫治疗,最常见的药物组合参见图 3。
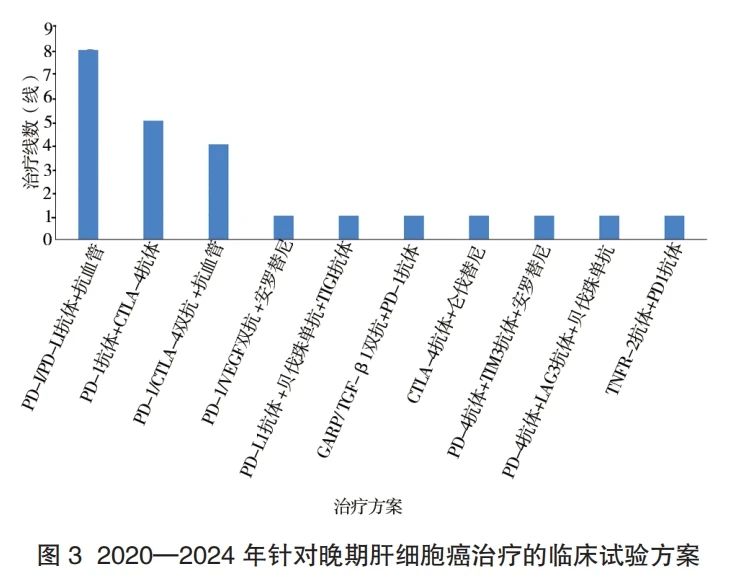
在 262 个于晚期≥ 2 线治疗患者开展的药物临床试验中,32 个(12.2%)在免疫治疗失败的晚期 HCC 患者中开展,目前均处于Ⅰ、Ⅱ期试验阶段。最常见的是免疫治疗 ± 靶向治疗,共计 13 个,占全部试验的40.6%;其中包括了 3 个双抗药物临床试验,其试验药物分别为 PD-1/ 转化生长因子 β(transforming growth factor β, TGF-β)双抗、PD-1/ 淋巴细胞活化基因 3 双抗、PD-L1/ 血管内皮生长因子(vascular endothelial growth factor, VEGF)融合蛋白。其次为细胞基因治疗,共计 9 个(28.1%),最常见的为 6 个不同基因修饰后的溶瘤病毒临床试验。另有 4 个(12.5%)为 ADC 药物临床试验。
3 讨 论
HCC 病死率在全部恶性肿瘤中位居第 3,是对全球健康的重大威胁。中国 HCC 发病率显著高于全球,病例数占全球总数的 45%[10],急需为这些患者寻找更好的治疗方式。随着多项Ⅲ期临床试验证实了抗血管生成联合 ICIs 在晚期肝癌 1 线治疗中的作用 [4,11],改变了以索拉非尼为代表的多靶点抑制剂 10 余年在 HCC 1 线治疗中的核心地位,HCC 治疗迈入了免疫治疗时代,HCC创新药物研发的格局也发生巨大变化。
本研究基于国际公认的临床试验数据库,总结了近5 年来全球由企业发起针对 HCC 的创新药物临床试验。本研究结果显示,针对 HCC 开展的临床试验数量占同期肿瘤药物临床试验的 4.3%,与其在全球肿瘤患者中所占比例(4.3%)一致 [1]。国内医药研发企业启动的肝癌临床试验占据了全球一半以上,高于国内医药研发企业所启动临床试验占全球试验的比例(35%)[12],体现出了国内医药研发企业在这一挑战性领域的不懈努力。然而,这一比例仍然低于中国 HCC 在全部恶性肿瘤患者中的比例(7.6%)[13],提示国内医药研发企业仍需进一步深耕本地,针对国内临床需求展开临床研发。
针对 HCC 的注册临床试验启动数量在 2022 年达到了顶峰,随后逐步下降,这一发展趋势与全球临床试验以及抗肿瘤临床试验启动趋势一致 [12,14]。其原因可能与全球生物制药公司接受投资减少密切相关 [12,14]。具体在肿瘤领域,ICIs 研发成功后,缺乏下一代改变肿瘤治疗格局的创新药物出现,也是影响临床试验数量的重要原因之一。
在临床试验涉及的试验药物中,传统的抗体类药物和小分子靶向药物仍然是最常见的创新药物类型。新型作用机制的药物,如双抗 / 多抗类药物、ADC 类药物不断涌现。双抗 / 多抗类药物中,PD-1/ 细胞毒 T 淋巴细胞相关抗原 4(cytotoxic T-lymphocyte-associated antigen4, CTLA-4) 双 抗、PD-1/VEGF 双 抗、GARP/TGF-β1双抗均已启动针对晚期 HCC 初治患者的Ⅲ期试验,以期能改变当前的晚期 HCC 治疗格局。ADC 类药物结合了抗体类药物的精准性和细胞毒药物的肿瘤杀伤作用,是近年来肿瘤创新药物研发的热点。截至 2023 年底,全球已有 15 个 ADC 药物获批,2023 年启动临床试验接近 200 个 [12]。在 HCC 中,目前也有 16 个药物在研发中。除了传统的 Trop2、HER2 靶点外,多项研究针对 B7-H3 等创新性靶点展开。也期待未来更多针对HCC 特异性靶点(如 GPC3[15] 等)研发 ADC 药物,并通过对药物结构及细胞毒成分的不断优化,提升药物治疗效果。
随着生物技术进步,细胞基因治疗手段逐渐成熟。随着 CART 细胞治疗被批准用于血液系统肿瘤治疗 [16],以 CART 细胞为代表的一系列细胞基因治疗也纷纷在实体瘤中开展早期临床试验,从而为晚期患者寻找新的治疗手段。本研究显示,在 HCC 相关临床试验中存在类似的趋势,如 15.4% 的试验药物均属于细胞基因治疗范畴,包括 CART、T 细胞受体工程化 T 细胞、肿瘤浸润淋巴细胞、溶瘤病毒、肿瘤疫苗等多种新型作用机制的药物。值得注意的是,共有 13 个溶瘤病毒及 9 个肿瘤疫苗在 HCC 中开展早期临床试验。溶瘤病毒是指利用基因工程的手段对天然病毒进行改造,定向感染肿瘤细胞,起到杀伤作用。基础研究显示,溶瘤病毒除直接肿瘤杀伤作用外,还可引发 T 细胞应答,存在与免疫治疗联合使用的巨大潜力[17]。而治疗性肿瘤疫苗则通过细胞、多肽、mRNA 或 DNA 等多种方式,呈递肿瘤抗原激活人体自身的抗肿瘤免疫,发挥治疗作用 [18]。以溶瘤病毒、肿瘤疫苗等为代表的多种创新性疗法在 HCC 中开展早期临床试验,拓宽了 HCC 治疗的可能方向,其研究结果值得持续关注。
从临床试验适应证来看,针对不可切除晚期 HCC的药物研究仍然是新药研发最重要的方向。随着 ICIs联合抗血管靶向治疗、ICIs 联合 CTLA4 抗体双免疫治疗先后被批准用于晚期 HCC 的 1 线治疗 [4,11,19-20],ICIs联合抗血管治疗或双免疫治疗已成为晚期 HCC 的基石性治疗手段。本研究发现,针对晚期 HCC 的 1 线治疗的临床研究,绝大多数也是在 ICIs 基础上增加新型免疫治疗药物,探索联合治疗的可能增效。值得注意的是,PD-1/CTLA-4 双抗、PD-1/VEGF 双抗均在晚期 HCC 的1 线治疗中开展了Ⅰ~Ⅲ期试验。双抗类药物能够同时结合 2 个不同的抗原或同一抗原的 2 个不同表位,理论上可以提供更多样化的治疗机制,可能产生与两种类似机制单抗类药物联用不同的疗效或安全性特征。此类药物在晚期 HCC 的 1 线治疗中的疗效值得期待。与 1 线治疗相比,晚期肿瘤后线治疗探索则更为多样。特别是在既往靶免治疗失败的患者中,细胞基因治疗相关试验的比例达到了 28.1%,高于此类试验在全部 HCC 临床试验中的比例,体现了创新机制药物在这一具有迫切临床需求的临床场景中的探索价值。
本研究存在一定的局限性。受限于试验数据的可获得性,本研究未纳入研究者发起研究,无法充分体现已有药物联合在不同治疗场景中的试验探索。同时,本研究中分析的临床试验几乎均处于试验开展过程中,无法分析其最终试验结果,上述创新药物是否最终能在HCC 治疗中取得较好疗效尚不得而知,仍需密切追踪。
综上所述,本研究通过对近 5 年来全球 HCC 药物注册临床试验的分析,展示了当前 HCC 药物研发的整体格局。全球范围内 HCC 药物临床开发较为活跃,中国企业研发在其中发挥重要作用。免疫治疗是 HCC 临床试验最为活跃的领域,而在后线 HCC 治疗中的细胞基因治疗也是重要的临床研究方向。建议国内医药研发企业加大针对 HCC 新药研发投入,挖掘更多新靶点和新作用机制药物,拓宽 HCC 治疗的可能方向。
参考文献
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics2022: GLOBOCAN estimates of incidence and mortality worldwide for 36cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229–263.
[2] GLOBAL BURDEN OF DISEASE LIVER CANCER COLLABORATION, AKINYEMIJU T, ABERA S, et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: results from the global burden of disease study 2015[J]. JAMA Oncol, 2017, 3(12): 1683-1691.
[3] 孙俪洋,潘扬勋,陈敏山 .2023年度肝癌治疗研究现状与问题 [/CDJ].肿瘤综合治疗电子杂志,2024,10(1):19-24.
[4] RS FINN, S QIN, M IKEDA, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma[J]. N Eng J Med, 2020,382(20): 1894-1905.
[5] 中国临床肿瘤学会指南工作委员会 .《中国临床肿瘤学会原发性肝癌诊疗指南》(2024 版 )[M]. 北京:人民卫 生出版社, 2024 :46-48.
[6] JIN Z C, ZHONG B Y, CHEN J J, et al. Real-world efficacy and safety of TACE plus camrelizumab and apatinib in patients with HCC(CHANCE2211): a propensity score matching study[J]. Eur Radiol,2023, 33(12): 8669-8681.
[7] 陈湘麒,张楠,赵海涛 . 肝细胞癌免疫联合靶向治疗方案中的瓶颈与对策 [J]. 中国实用外科杂志,2024,44(9):1021-1027.
[8] SCHOENFELD A J, HELLMANN M D. Acquired resistance to immune checkpoint inhibitors[J]. Cancer Cell, 2020, 37(4): 443-455.
[9] Informa Pharma Intelligence. Informa intelligence[DB/OL](2022-10-28)[2024-12-10]. https://www.informa.com/divisions/informa-intelligence.
[10] MCGLYNN K A, PETRICK J L, GROOPMAN J D, et al. Liver cancer: progress and priorities[J]. Cancer Epidemiol Biomarkers Prev, 2024,33(10): 1261-1272.
[11] REN Z, XU J, BAI Y, et al. Sintilimab plus a bevacizumab biosimilar(IBI305) versus sorafenib in unresectable hepatocellular carcinoma(ORIENT-32): a randomised, open-label, phase 2-3 study[J]. Lancet Oncol, 2021, 22(7):977-990.
[12] IQVIA INSTITUTE. Global oncology trends 2024: outlook to 2028[Z].https://www.iqvia.com/.../global-oncology-trends-2024.
[13] HAN B, ZHENG R, ZENG H, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[14] IQVIA INSTITUTE. Global trends in R&D 2023: activity, productivity,and enablers[Z]..https://www.farmindustria.it/app/uploads/2023/02/iqvia-institute-global-trends-in-rd-2023-forweb.pdf.
[15] ZHOU F, SHANG W, YU X, et al. Glypican-3: a promising biomarker for hepatocellular carcinoma diagnosis and treatment[J]. Med Res Rev,2018, 38(2): 741-767.
[16] LU J, JIANG G. The journey of CAR-T therapy in hematological malignancies[J]. Mol Cancer, 2022, 21(1): 194.
[17] MA R, LI Z, CHIOCCA E A, et al. The emerging field of oncolytic virus-based cancer immunotherapy[J]. Trends Cancer, 2023, 9(2):122-139.
[18] LIU N, XIAO X, ZHANG Z, et al. Advances in cancer vaccine research[J]. ACS Biomater Sci Eng, 2023, 9(11): 5999-6023.
[19] MELERO I, YAU T, KANG Y K, et al. Nivolumab plus ipilimumab combination therapy in patients with advanced hepatocellular carcinoma previously treated with sorafenib: 5-year results from CheckMate 040[J]. Ann Oncol, 2024, 35(6): 537-548.
[20] ABOU-ALFA G, LAU G, KUDO M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma[J]. NEJM Evid, 2022, 1(8): EVIDoa2100070.
来源:E肝癌电子杂志