
为了响应《“健康中国2030”规划纲要》,实现我国全民消化肿瘤早诊早治,《肿瘤界》设立“齐力荟聚-消化肿瘤频道”,聚焦消化肿瘤患者的诊断治疗。旨在报道国内前瞻性、创新性和高学术水平的关于消化道肿瘤防治的临床应用和基础研究,把握学术发展动向,促进学术交流,整体提高国内消化肿瘤防治的临床与研究水平,结合国内研究特色,以及国内临床规范制度,推动消化肿瘤防治的进步,普及推广临床规范化诊疗。
专家访谈
专家简介

在全球,肝癌发病率居常见恶性肿瘤第六位,其死亡率居第三位,全球有超过55%的新发病例在中国确诊。近年来,随着分子靶向药物与免疫药物的出现,肝癌领域迎来了新的时代。为进一步改善肝癌患者预后和提高生存质量,学界不断探索更多新的治疗药物及治疗模式,近年来也有研究成果陆续公布。
问题一:请您谈谈现阶段国内外肝癌的治疗模式有哪些区别?主要治疗手段有哪些?
我国肝癌在发病原因、分子生物学特征和流行病学特点、临床表现与分期、治疗的策略与手段上,都与国外有一定差异,是具有中国特色的肿瘤之一。
目前国内以综合治疗、多学科治疗为主。治疗手段包括手术、消融、肝移植、介入、系统治疗及放疗等。
我国的肝癌外科治疗水平一直走在世界的前列,肝癌的外科治疗是肝癌患者获得长期生存的重要手段,主要包括肝切除术和肝移植术。尽管外科手术是肝癌的首选治疗方法,但因肝癌患者大多合并有肝硬化,或者在确诊时大部分已达中晚期,只有约20%的患者能获得手术切除机会,局部消融治疗因具有创伤小、疗效确切的特点,使一些不耐受手术切除的肝癌患者亦可获得根治的机会。
索拉非尼的问世开辟了肝癌的靶向治疗时代,之后国际上又开展了一系列肝癌靶向药物的临床研究,我们目前有了包括仑伐替尼、多纳非尼、瑞戈非尼等靶向药物。
肝癌免疫治疗主要包括免疫检查点抑制剂如 PD-1/PD-L1 抑制剂、免疫调节剂如干扰素、肿瘤疫苗如树突细胞疫苗和细胞免疫治疗,有的已经应用于临床,部分还处于临床研究阶段,仍需大规模的临床研究进一步验证。
介入治疗包括TACE、HAIC等局部治疗,在肝癌综合治疗中具有重要地位。
问题二:PD-1/PD-L1抑制剂联合抗血管生成治疗是目前研究热点。请您结合研究进展,谈谈免疫治疗联合靶向治疗有哪些新的突破?
PD-1/PD-L1抑制剂联合抗血管生成治疗是目前研究热点。其中,Keynote 524/Study 117研究,即Pembro或Nivo+仑伐替尼一线治疗无法切除HCC的单臂、I b期研究初步显示了联合治疗的疗效。Keynote 524研究显示,仑伐替尼+Pembro中位OS时间达到22个月,中位PFS时间为9.3个月,令人惊喜的是,ORR高达46%。Study 117研究显示,仑伐替尼+Nivo中位OS时间达到7.39个月,ORR高达76.7%。但需要特别关注此类联合治疗的毒性,相关研究显示,3级以上AEs发生率高达60%~91%。
国内已批准的肝癌系统治疗一线治疗方案T+A(阿替利珠单抗+贝伐珠单抗)临床疗效优异,安全性高,其IMbrave 150研究显示,中位OS时间达到19.2个月,中国人群中位OS时间达到24个月。
新获批准的信迪利单抗联合贝伐珠单抗一线治疗晚期肝癌较索拉非尼显著延长患者生存,降低43%的死亡风险(HR=0.569,P<0.0001)和43%的疾病进展风险(HR=0.565,P<0.0001)。
以上研究都为临床医生给肝癌患者制定系统治疗方案提供了很好的数据。
问题三:近3年来,仑伐替尼因其优异的临床数据以及实际临床应用,成为肝癌一线治疗的基石。请您结合临床研究,谈谈仑伐替尼在中晚期肝癌治疗上有哪些新的治疗进展?
新的小分子靶向药物发展迅速,其中应用最广泛、最成熟的是仑伐替尼,应用的患者数量及临床经验更多。仑伐替尼具有抑制血管生成和肿瘤细胞增殖双重抗瘤机制,被众多权威指南一致推荐用于晚期HCC的一线治疗。
中晚期肝癌(CNLC IIb-IIIa期)患者单纯手术的疗效并不理想,术后复发率较高。复旦大学附属中山医院肝癌研究所肝肿瘤外科周俭教授团队进行了一项前瞻性、多中心、单臂研究。该研究共入组了24例IIb/IIIa期(病灶数量≥3或血管侵犯)的HCC患者,所有患者需满足肝功能Child-Pugh评分≤7分、ECOG评分0~1分、无肝外扩散,在R0根治性切除术后口服仑伐替尼,初步分析结果提示中位RFS时间为9.03个月。与既往单纯手术的IIb/IIIa期患者相比有了进一步的改善,初步提示了仑伐替尼在高危复发患者中预防或减少术后复发的可能性。
TACTICS-L研究是日本著名肝癌学者Masatoshi Kudo教授开展的一项前瞻性、单臂、II期临床研究。该研究目前共纳入了62例不可手术切除HCC患者,所有患者需满足肝功能Child-Pugh评分≤7分、ECOG评分0~1分、无血管侵犯、无肝外扩散、病灶大小≤10cm且数量≤10个且无器官功能衰竭。所有患者接受口服仑伐替尼联合TACE治疗。研究的主要终点为PFS时间,次要终点包括至发生无法治疗肿瘤进展的时间(TTUP)、ORR、OS和安全性。研究结果显示仑伐替尼与TACE联合治疗的ORR高达79%(90% CI:68.7%~87.1%),其中完全缓解(CR)率高达53.2%。而在既往报道的TACTICS研究中,单独TACE组ORR为61.8%,CR率为27.6%。该研究初步提示了仑伐替尼联合TACE在部分不可切除HCC患者中的巨大治疗价值和应用前景。
复旦大学附属中山医院肝癌研究所肝肿瘤内科任正刚教授团队回顾性分析了中国真实世界中2018年4月至2020年4月46例晚期不可切除肝癌一线仑伐替尼进展后再接受仑伐替尼加PD-1抑制剂(pembrolizumab或trialimab)的晚期不可切除肝癌患者(uHCC),排除接受其他系统治疗的患者。主要结局包括:ORR、PFS和联合治疗开始至进展或死亡的时间,采用RECIST v1.1进行评估。治疗相关不良事件(TRAE)采用CTCAE v5.0进行评估,治疗期间患者生活质量(QOL)采用EORTC QLQ-C30和EORTC QLQ- HCC18问卷进行评估。初步研究结果提示,mPFS时间为6.9个月(95% CI:2.1~11.8),mOS时间为14.5个月(95% CI:6.8~22.3)。仑伐替尼联合PD-1抑制剂有望在仑伐替尼单药治疗进展后进一步改善患者的预后;同时,单用仑伐替尼进展后的uHCC患者加用免疫治疗耐受性良好,QOL有改善。该真实世界的数据提示,仑伐替尼单药治疗进展后,继续联合免疫治疗的研究值得开展更高质量的随机对照研究进一步评价。
问题四:肝癌局部治疗联合系统治疗有哪些新的进展?
HAIC/TACE+靶向+免疫的联合治疗方法被广泛使用,可协同增效。
HAIC/TACE的作用主要是:快速降低局部肿瘤负荷;引起肿瘤局部缺氧,导致血管生成因子分泌增加,促进新生血管形成;影响肿瘤微环境,使免疫抑制分子PD-1/CTLA-4表达上调。靶向药物的作用主要有:作用于VEGFR等血管生成靶点,抗血管生成;作用于VEGFR、CSF-1R等靶点,抗免疫抑制;抗肿瘤细胞增殖;抗肿瘤转移。免疫药物的作用主要是抑制PD-1/PD-L1和抑制CTLA-4。
一项多中心、开放标签、随机、平行组Ⅲ期研究,纳入247例合并门静脉侵犯的HCC患者,随机接受索拉非尼+HAIC(n=125)和索拉非尼单药(n=122)治疗,相较于索拉非尼单药组,索拉非尼+HAIC组患者中位OS、PFS、肝内PFS均显著获益。
我国肝癌患者确诊时多已到了中晚期,难以行根治性手术,单一治疗方法往往不理想,通过MDT,综合运用各种治疗手段为肝癌患者提供个体化的精准医疗方案,有助于提高疗效,延长患者生存期,改善患者生活质量。
病例分享
专家简介

基本情况
基本信息:廖某某(病历号35XX37);男 43岁;身高 159cm;体重 71Kg。
主诉:主因“肝病史30年,肝癌1月余”于2021-12-3日来我院就诊。
现病史:患者30年前体检发现乙肝标志物阳性,此后未定期复查,未行抗病毒治疗。1月前无明显诱因出现上腹部不适,于当地医院行腹部CT提示肝右前叶占位、腹膜后多发肿大淋巴结,考虑转移。就诊于我院门诊行腹部增强MRI(2021-12-16)提示肝右前叶上段肝癌、腹腔及腹膜后多发淋巴结转移、肝内胆管扩张。行肝穿刺活检术,术后病理结果示(2021-12-24):穿刺组织内低分化腺癌浸润,伴坏死,免疫组化支持胆管来源。
既往史:平素健康状况良好。
个人史:否认长期放射线或毒物接触史,吸烟20余年,日均吸烟40支,戒烟5年;偶尔饮酒。否认冶游史。
家族史:父亲患乙肝,母亲体健。育有2子1女,儿女体健。1个哥哥及妹妹均患乙肝,有乙肝家族史。
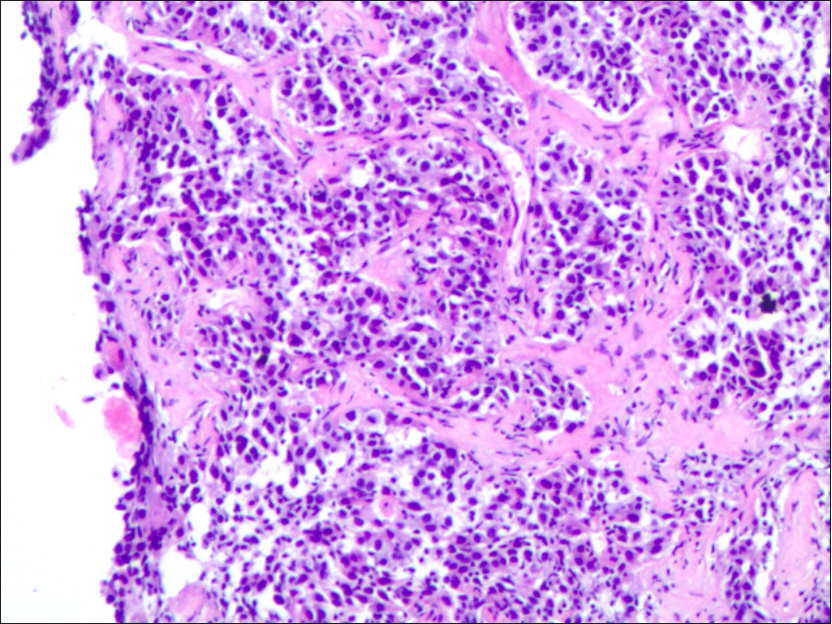
附图1:肝穿刺活检术后病理结果回报(2021-12-24):穿刺组织内低分化腺癌浸润,伴坏死,免疫组化支持胆管来源。
初诊病史
入院实验室检查(2021-12-20):
血常规:白细胞:8.37×109/L;血红蛋白:113g/L;血小板265×109/L。
肝功能:ALT 67U/L;AST 52U/L;TBIL 48.4μmol/L;ALB 34.7g/L。
凝血功能检查:PT:12.6S;PTA:83%。
甲胎蛋白:5.95ng/ml(正常值≤7ng/ml);CA199:230 U/ml(正常值≤30U/ml)↑↑;CEA:0.507ng/ml(正常值≤30ng/ml)。
乙肝五项:HBsAg(+)、抗-HBs(+)、HBeAg(-)、抗-Hbe(+)、抗-HBc(+)。
乙肝病毒载量:1.13×103 IU/ml。
丙肝抗体:阴性。
上腹部增强MRI(2021-12-16)结果回报:肝右前叶上段肝癌,大小约53mm×71mm,腹膜及腹膜后多发淋巴结转移;肝内胆管扩张;肝囊肿;右肾旋转不良。
治疗方案
根据《中国临床肿瘤学会(CSCO)胆道恶性肿瘤诊疗指南2020》,患者肿瘤分期为IIIb期,经过MDT会诊,结合患者经济情况、体能情况、诊疗意愿等,参考《肝癌转化治疗中国专家共识(2021版)》,为患者制定了GEMOX(奥沙利铂+吉西他滨)化疗联合仑伐替尼+信迪利单抗靶免治疗方案。
分别于2022-1-11/2-7/2-28/3-21/4-11/5-5 行奥沙利铂175mg d1+吉西他滨1600mg d1、d8静脉滴注化疗,同时联合仑伐替尼8mg Qd+信迪利单抗200mg 每21天一个疗程,共计6个疗程。过程顺利,患者耐受可,无明显不良反应。
疗效评估
患者经过化疗联合靶免联合治疗,每个疗程复查肿瘤标志物,经过1个疗程治疗后,CA199水平由230 U/ml降至7.81U/ml,已完全恢复正常水平。
每2个疗程进行影像学评估,可见肿瘤体积明显缩小。根据RECIST标准,2个疗程后靶病灶为部分缓解(PR),4个疗程后靶病灶为疾病稳定(SD)。目前拟择期对6个疗程治疗后的腹部情况进行检查,若符合手术适应证,拟转化行外科手术切除。
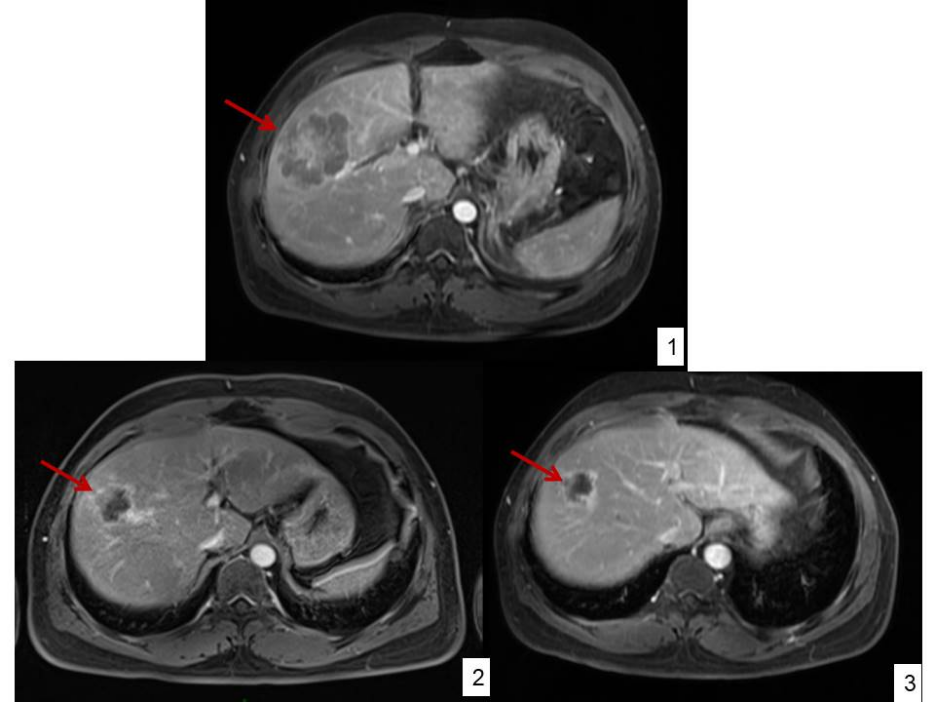
附图2:1)2021-12-16 治疗前:肝右前叶上段见大小约53mm×71mm团块状信号影。2)2022-2-25 2个疗程后:肝右叶占位大小约34mm×36mm,较前明显缩小。3)2022-4-12 4个疗程后:肝右叶占位大小约28mm×25mm,较前缩小。
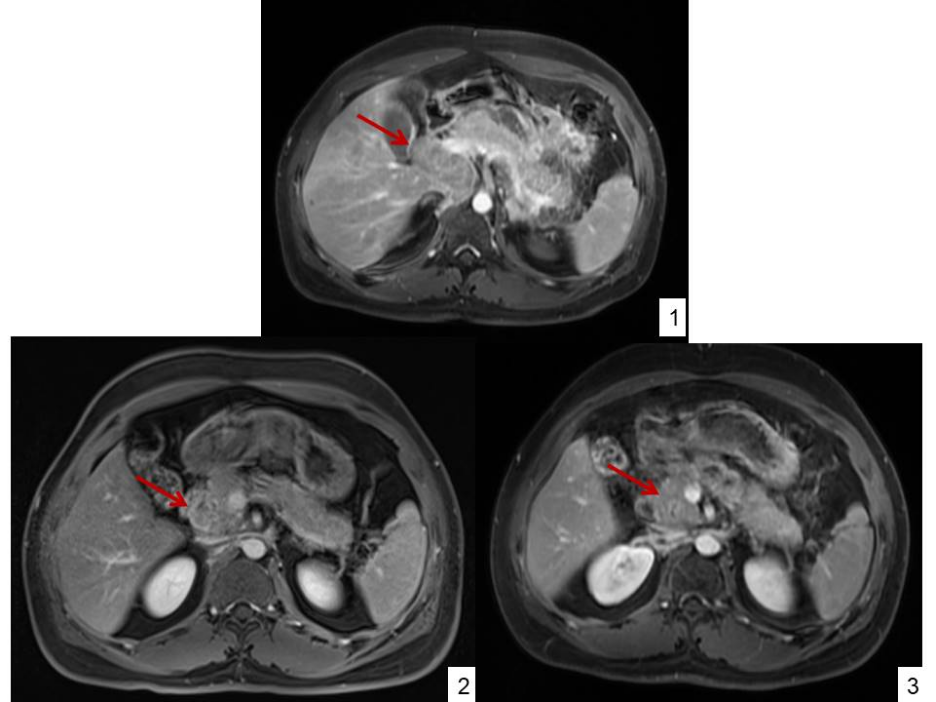
附图3:1)2021-12-16 治疗前:可见腹腔及腹膜后多发淋巴结转移,部分融合成片,直径约60mm×29mm。2)2022-2-25 2个疗程后:腹腔及腹膜后淋巴结较前缩小,直径约39mm×23mm。3)2022-4-12 4个疗程后:腹腔及腹膜后淋巴结较前缩小。
*本文仅代表专家观点,并经专家审校。
