间质-上皮细胞转化因子(MET)被认为是继表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)之后又一重要的非小细胞肺癌(NSCLC)分子治疗靶点1。NSCLC中MET异常(MET alteration)包括MET基因第14号外显子跳跃突变(MET 14跳突)、MET基因扩增、MET基因点突变(主要是激酶区突变)、MET基因融合及MET蛋白过表达等。准确检测MET异常是实施MET抑制剂治疗的前提2。MET异常形式和检测方法多,选择准确、快速、恰当的检测方法,全面筛选出适用靶向和免疫药物的目标人群具有重要临床意义3,本文针对MET 14跳突的临床意义及检测方法进行介绍。
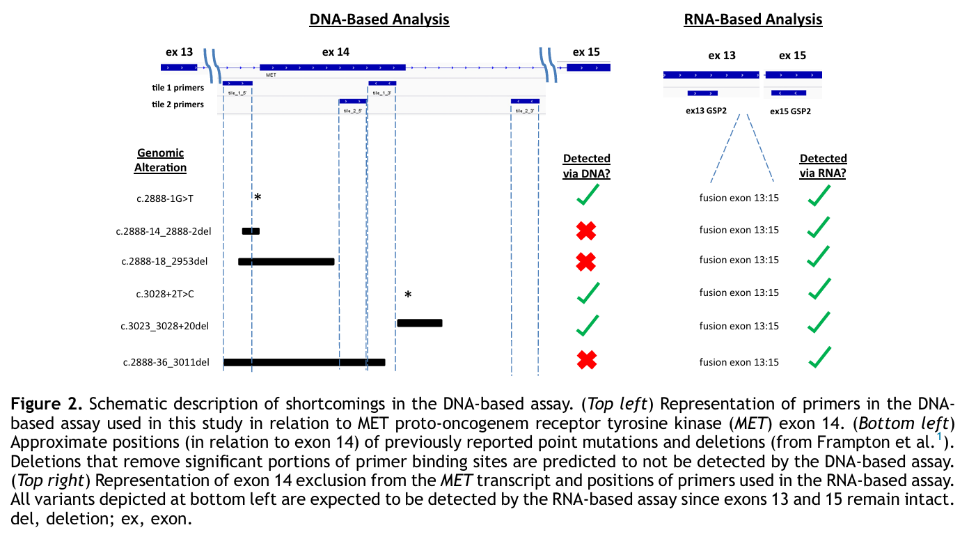
NSCLC患者中MET 14跳突的发生率为0.9%~4.0%,MET 14跳突是晚期NSCLC的驱动基因突变之一,是筛选MET抑制剂靶向治疗获益人群的重要分子标志物。MET蛋白可通过Casitas B系淋巴瘤(CBL)E3泛素连接酶介导的泛素化降解进行负向调控。MET基因第14号外显子编码的近膜结构域中包含CBL结合位点(Y1003),是MET蛋白负向调控的重要区域。CBL与Y1003结合并介导MET蛋白泛素化,从而导致MET蛋白降解。MET 14跳突造成的MET蛋白近膜结构域缺失、Y1003位置氨基酸改变或缺失等变异形式均可导致MET蛋白泛素化障碍、MET稳定性增加和降解减少,从而引起下游信号的持续激活2。 目前已报道的MET 14跳突主要发生区域包括分支位点(branch site,单核苷酸)区域、多嘧啶区域(poly-pyrimidine tract,16个核苷酸)、剪接受体位点(splice acceptor site,上游2个核苷酸)以及剪接供体位点(splice donor site,下游2个核苷酸)(如图1)。当以上区域发生突变时,将导致mRNA异常剪接,表现为MET第14号外显子区域丢失,第13与15号外显子发生融合。MET 14跳突常见的突变位点分布区域较广,且突变形式多样,是临床检测和判读中面临的挑战2。 图1. MET第14号外显子跳跃突变主要分布区域 MET 14跳突的检测方法主要包括定量逆转录聚合酶链反应(reverse transcription quantitative-polymerase chain reaction,RT-qPCR)、DNA二代测序(next generation sequencing,NGS)和RNA二代测序等,不同检测方法各有其优缺点,必要时可相互验证或补充(如表1)。 1. RT-qPCR: 以RNA为检测对象,在MET第13和第15号外显子区域设计引物,检测是否有特异性的扩增产物,该方法检测MET 14跳突准确率高,但对于一些与MET 14跳突功能相似的、特殊且罕见的MET变异形式,如Y1003位点氨基酸改变(约占总体阳性的2%)或缺失,会导致漏检。对于检测结果在阳性阈值附近的患者,其结果解释需谨慎,应结合样本质量、肿瘤细胞含量以及检测质控情况综合分析。必要时可使用其他平台进行复测2。 特点:能够较准确快速地探测到MET 14跳突的存在,兼具敏感性和特异性,检测周期短,适用于组织及细胞学样本3。 2. DNA-NGS: 优选肿瘤组织样本或细胞学样本进行检测,目前试剂盒主要基于2种建库方法,扩增子法和杂交捕获法,富集MET 14跳突相关区域片段以进行基因序列检测。考虑到导致MET 14跳突的变异位点和形式多样性,不同建库方法的检测能力也有一定差别,推荐建库的靶向序列至少应覆盖全部MET 13内含子、MET 14外显子以及MET 14外显子下游50 bp的范围(MET 14内含子内)。二代测序生物信息分析的数据库应尽可能包含全面的MET 14跳突位点信息,并定期更新。部分以DNA为基础的NGS探针难以同时覆盖14号外显子两端的广泛位点基于DNA的检测可能存在漏检(如图2)4。对于检测到的疑似MET 14跳突,在生物信息分析预测的基础上,建议辅以RT-qPCR或RNA测序验证。DNA二代测序平台在基于上述因素的充分优化后,也能达到较高的灵敏度与特异度。当肿瘤组织样本和细胞学样本不可及时,可考虑液体活检样本进行DNA二代测序检测。ctDNA在肿瘤患者体内含量较低,对检测方法灵敏度的要求较高,可能存在假阴性;ctDNA检测也同样会受到检测探针覆盖的影响。因此,在使用液体样本检测时,需充分考虑这些局限性,当出现阴性结果时,应注明假阴性的可能性2。 特点:可在DNA层面直接鉴定出MET 14外显子区域碱基对突变的具体情况,是目前检测MET 14外显子跳跃突变最常用的手段,但检出率会受到引物设计或探针覆盖及生物信息分析能力的影响,且周期相对较长,优选肿瘤组织或细胞学样本,当上述样本无法获得时,也可考虑液体活检样本3。 图2. 基于DNA及RNA检测的对比 3. RNA-NGS: 在RNA水平上检测MET第13/15号外显子融合来判断是否发生MET 14跳突。该方法直接检测MET 14跳突,检测覆盖范围明确,生物信息分析简单。尤其当患者发生影响剪接的非典型内含子突变时,该方法有助于识别MET 14跳突。但与RT-qPCR一样,对于一些罕见的MET变异形式(如Y1003位点氨基酸改变或缺失)可能会出现漏检。RNA二代测序同样对样本质量要求高,检测全程需做好质控2。 特点:在RNA水平上检测MET 13/15外显子融合来判断是否发生MET 14跳突,即使肿瘤细胞数量较少的样本,也可保持较高感性3。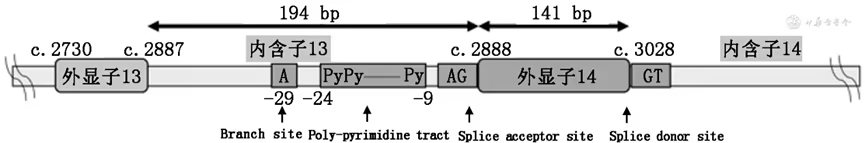

参考文献: 1. 中国老年保健协会肺癌专业委员会. MET 14外显子跳跃突变NSCLC靶向治疗专家共识[J].中国肺癌杂志,2023,26(6):416-428. DOI:10.3779/j.issn.1009-3419.2023.102.19. 2. 中华医学会病理学分会, 国家病理质控中心, 中华医学会肿瘤学分会肺癌学组, 中国抗癌协会肺癌专业委员会, 中国胸部肿瘤研究协作组. 非小细胞肺癌MET临床检测中国专家共识[J]. 中华病理学杂志, 2022, 51(11) : 1094-1103. DOI: 10.3760/cma.j.cn112151-20220606-00491. 3. 国家病理质控中心, 中华医学会病理学分会, 中华医学会肿瘤学分会肺癌学组, 中国抗癌协会肺癌专业委员会, 中国胸部肿瘤研究协助组. 非小细胞肺癌分子病理检测临床实践指南(2024版)[J]. 中华病理学杂志,2024,53(10):981-995. DOI:10.3760/cma.j.cn112151-20240527-00338. 4. Davies KD, Lomboy A, Lawrence CA, Yourshaw M, Bocsi GT, Camidge DR, Aisner DL. DNA-Based versus RNA-Based Detection of MET Exon 14 Skipping Events in Lung Cancer. J Thorac Oncol. 2019 Apr;14(4):737-741. doi: 10.1016/j.jtho.2018.12.020. Epub 2019 Jan 9. PMID: 30639620.
来源:肿瘤界