EB病毒(Epstein-Barr virus, EBV)属于γ-疱疹病毒,与多种疾病密切相关,涵盖传染性单核细胞增多症、多发性硬化症、自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮)以及多种肿瘤(如鼻咽癌、EBV相关性胃癌、NK/T淋巴瘤、霍奇金淋巴瘤及伯基特淋巴瘤)。EBV是首个被发现的人类肿瘤病毒,全球每年约有20万例新发EBV相关肿瘤患者,主要为B淋巴细胞及上皮细胞起源的肿瘤。EBV主要感染B淋巴细胞和上皮细胞,尽管科学家早已发现EBV感染B细胞的关键受体CD21(CR2)和HLA II,但EBV感染上皮细胞的机制一直是未解之谜。
此前,曾木圣教授团队通过首创的EBV体外高效上皮细胞感染模型,已陆续发现多个EBV感染上皮细胞的关键受体(如介导黏附的NMHC-IIA、介导内化的NRP1及触发膜融合的EphA2)。传统观点认为,EBV利用截然不同的受体感染这两类细胞,但gH/gL和gB糖蛋白是EBV感染所有宿主细胞所必需的,且针对gH/gL的中和抗体能同时阻断EBV感染B细胞和上皮细胞,这提示可能存在一种通用型关键受体,只是长期以来未被发现。

曾木圣教授指导团队成员实验
为了探讨是否存在EBV通用型受体,曾木圣教授团队首先利用早期建立的EBV高效感染的鼻咽上皮细胞模型进行干扰文库筛选,发现敲低R9AP表达可显著抑制EBV感染鼻咽上皮细胞。随后,团队在多种上皮细胞及B淋巴细胞来源细胞系中对该结果进行了验证,发现R9AP在这两种宿主细胞--上皮细胞及B淋巴细胞中均能介导EBV感染。
R9AP (RGS9 anchor protein) 由RGS9BP基因编码。既往研究发现该蛋白主要表达在视网膜感光细胞中,其功能为细胞浆可溶性蛋白的膜锚定蛋白。本研究利用RT-qPCR、Western blot、流式细胞术和免疫荧光及免疫组化染色证实了R9AP表达在外周血和扁桃体B淋巴细胞、多种上皮细胞以及多种EBV相关肿瘤细胞中。既往研究认为R9AP的N端1-210氨基酸定位于胞内。本研究通过网站预测及多项实验证实,R9AP的N端1-210氨基酸亦可定位于细胞膜外,从而与EBV接触介导EBV感染。这项研究颠覆了R9AP只在视觉细胞发挥功能的固有认识,并且首次发现了该蛋白可在细胞膜双向定位。
为了深入探究R9AP在EBV感染过程中的作用机制,团队开展了大量研究。他们发现,R9AP作为EBV受体,其N-端与EBV糖蛋白gH/gL相互作用,在EBV感染B淋巴细胞与上皮细胞过程中均起关键作用。此外,团队开发了针对R9AP的特异性单克隆抗体及R9AP衍生短肽,二者均能显著抑制EBV感染上皮细胞及B淋巴细胞,并且R9AP衍生短肽抑制EBV感染的结果在人源化小鼠体内也得到了验证。
该研究还揭示了R9AP与gH/gL复合物的直接相互作用及其在融合中的核心作用,为后续开发靶向该通路的高效、广谱抗EBV药物和疫苗提供了直接的分子靶标和坚实的病毒学基础;阐明了R9AP在两类细胞中分别与已知的关键受体(B细胞中的HLA-II和上皮细胞中的EphA2)协作,触发相似的病毒膜融合过程,从而弥合了两种细胞受体谱系的差异,揭示了高度统一的EBV感染核心机制,为理解这一核心过程提供了统一的理论框架。
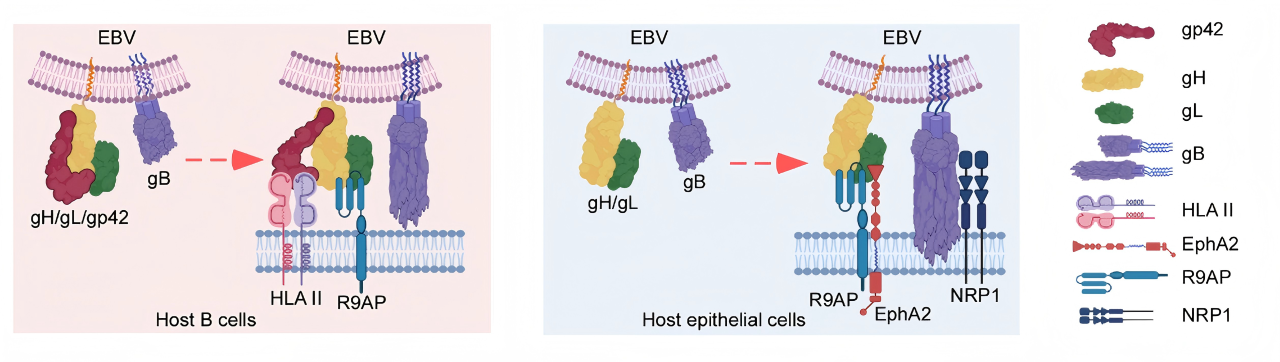
机制研究示意图
总的来说,该研究结果证实R9AP为EBV感染B淋巴细胞与上皮细胞的必需因子,首次发现了介导EBV感染这两种细胞的通用受体,打破了传统上两种细胞受体应截然不同的固有认识。这一发现不仅解决了EBV领域长期存在的关键科学难题,还拓展了人们对R9AP生物学作用的理解与认识。
研究成果于2025年6月18日在国际顶级期刊《自然》(Nature)发表。中山大学肿瘤防治中心曾木圣教授、钟茜教授为本文的共同通讯作者。中山大学肿瘤防治中心李燕副主任医师、中山大学医学院张华副教授、中山大学肿瘤防治中心孙聪博士及董晓东博士为本文的共同第一作者。该研究也获得国家重点研发计划、国家自然科学基金重点项目等基金支持。

来源:中大科研