2025年7月29日,广州医科大学许雯雯教授/李斌教授、河南省肿瘤医院(中国医学科学院肿瘤医院河南医院) 陈小兵教授共同通讯在Advanced Science在线发表题为“NAT10 Increases Lysosomal Acidification to Promote Esophageal Cancer Metastasis via ac4C Acetylation of ATP6V0E1 mRNA”的研究论文。该研究揭示了NAT10在诱导溶酶体酸化中的新作用,并阐明了ATP6V0E1在肿瘤转移中的临床及生物学意义。

研究背景
转移是人类癌症最显著的特征,也是导致癌症患者死亡的主要原因。探索癌症转移的治疗性生物标志物并开发针对性治疗策略已成为当务之急。近年来,越来越多的研究表明,基因组改变无法完全解释癌症进展的潜在机制。RNA表观转录组学,尤其是RNA修饰,已被证实参与人类疾病的多种生物学过程。近期研究发现,哺乳动物mRNA存在N4-乙酰胞苷(ac4C)乙酰化修饰,该修饰可增强mRNA的稳定性和翻译效率,而N-乙酰基转移酶10(NAT10)是目前已知唯一催化该修饰的酶。值得注意的是,NAT10作为唯一同时具有乙酰转移酶结构域和RNA结合结构域的蛋白质,近期被报道可促进肿瘤发生和转移,但其具体作用机制尚未明确。
自噬是一种通过清除分子和亚细胞成分以维持能量平衡的基本细胞过程,已有研究表明自噬参与调控肿瘤细胞的运动和侵袭能力。自噬起始于双层膜结构的形成,这些膜结构包裹细胞质成分并延伸形成自噬体,最终与溶酶体融合形成自噬溶酶体。因此,自噬在很大程度上依赖于溶酶体内的酸性环境,该环境由液泡型H⁺-ATP酶(v-ATPase)的质子泵活性维持,且在肿瘤转移中发挥重要作用。v-ATPase是一种多亚基复合物,由外周的V1结构域和跨膜的V0结构域组成。截至目前,NAT10介导的ac4C修饰是否调控v-ATPase亚基及自噬-溶酶体通路仍不明确。本研究通过整合乙酰化RNA免疫沉淀测序(acRIP-seq)和一系列实验发现,在v-ATPase相关亚基中,仅ATP酶H⁺转运V0亚基e1(ATP6V0E1)存在ac4C修饰。作为溶酶体膜上质子泵v-ATPase的重要组成部分,ATP6V0E1负责调节溶酶体内腔的酸性水平。但目前,ATP6V0E1在肿瘤发生中的生物学功能及临床意义尚未见报道。
食管癌是全球第七大常见癌症和第六大致命癌症,对人类健康构成严重威胁。食管鳞状细胞癌(ESCC)占食管癌的70%以上,其特点是侵袭性强、转移范围广。然而,针对这种致命疾病的靶向药物极为匮乏,开发有效的治疗策略迫在眉睫。本研究旨在探究NAT10介导的ac4C修饰在调控溶酶体酸化中的重要作用,阐明ATP6V0E1作为ac4C修饰的新底物在促进癌症转移中的生物学功能及其在ESCC中的临床意义。研究数据表明,选择性靶向ac4C修饰以抑制溶酶体功能异常可能成为一种潜在的治疗策略。因此,本研究致力于阐明肿瘤转移的新机制,并为晚期ESCC 患者提供潜在的治疗方案。
研究内容
NAT10通过ac4C修饰调控ATP6V0E1表达
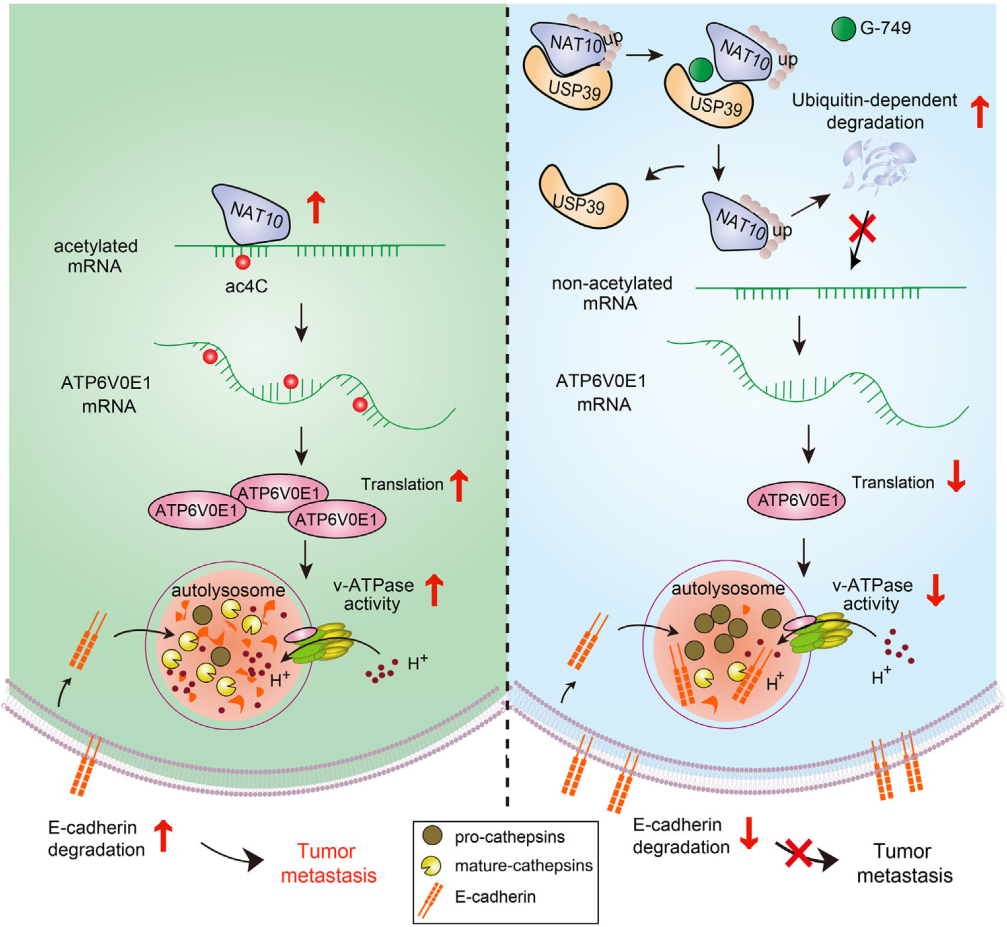
分子机制:NAT10通过ac4C修饰ATP6V0E1 mRNA的编码区(CDS),增强其稳定性和翻译效率,进而上调v-ATPase活性,促进溶酶体酸化。
实验验证:acRIP-seq和RNA-seq联合分析显示,ATP6V0E1是NAT10 介导的ac4C修饰的唯一v-ATPase亚基靶点。敲减NAT10可显著降低 ATP6V0E1的ac4C修饰水平及蛋白表达。
溶酶体酸化增强促进转移的机制
功能实验:NAT10过表达显著增强溶酶体酸性(LysoTracker检测),促进组织蛋白酶D(cathepsin D)成熟及E-钙粘蛋白(E-cadherin)的溶酶体降解,从而增强细胞侵袭能力。敲减NAT10或ATP6V0E1则逆转上述效应。
体内验证:裸鼠转移模型显示,NAT10敲减或ATP6V0E1抑制可显著减少肺转移灶数量,而过表达ATP6V0E1可部分恢复转移能力。
临床样本相关性分析
表达模式:免疫组化(IHC)显示,NAT10和ATP6V0E1在食管癌组织中高表达,且与肿瘤浸润深度、淋巴结转移及TNM分期呈正相关。蛋白质组学证据:20例ESCC组织的蛋白组分析显示,溶酶体相关水解酶(如cathepsin D、L、S)在转移灶中显著上调,与溶酶体酸化水平呈正相关。
本研究系统阐明了NAT10通过ac4C乙酰化修饰ATP6V0E1 mRNA,增强溶酶体酸化,最终促进食管癌转移的分子机制。该发现不仅丰富了 RNA表观遗传修饰在肿瘤转移中的作用理论,还为食管癌的预后预测和靶向治疗提供了潜在生物标志物和新靶点。未来研究可进一步探索 NAT10在其他肿瘤转移中的作用,或开发针对NAT10-ac4C-ATP6V0E1轴的小分子抑制剂,为临床转化奠定基础。
专家简介

许雯雯 教授
广州医科大学基础医学院教授、博导、呼吸疾病全国重点实验室PI。
长期从事食管癌研究,聚焦于食管癌肿瘤微环境的细胞通讯和分子机制,以及相关的临床转化。
主持国家自然科学基金项目4项、广东省-澳大利亚国际合作1项、省市科研基金多项,作为国家重点研发计划子课题负责人参与国家重点研发计划2项。入选广东省杰出青年、广东省青年“珠江学者”、“南山学者”领军人才、香港青年科学家、“王宽诚教育基金会”青年教授。近年来,以通讯或第一作者发表SCI论文20余篇,包括Nature Genetics、Advanced Science (2022,2023,2025)、Signal Transduction and Targeted Therapy (2020,2021)、Nature Communications、EbioMedicine、Acta Pharmaceutica Sinica B、Small methods、Clinical Cancer Research、Oncogene、Cancer Letters等,另有文章在Cancer Cell审稿中。
担任香港大学荣誉助理教授、中国抗癌协会整合肿瘤分会青年委员、中国抗癌协会肿瘤标志物分会青年委员,任Frontiers in Oncology杂志编辑和多个SCI杂志的审稿人。作为第一发明人已获授权中国发明专利10项。

李斌 教授
广州医科大学教授、博导,呼吸疾病全国重点实验室PI,附属五院医学研究中心主任,广州市医学重点学科肿瘤学带头人,广东省生物靶向诊治与康复重点实验室副主任,曾任肿瘤分子生物学教育部重点实验室副主任。
20年来聚焦食管癌转移和免疫,主要进行翻译后修饰表观遗传研究及靶向干预探索。主持国家自然科学基金4项、国家重点研发计划子课题2项及省市重点和国际合作项目多项。近五年,以通讯作者发表SCI论文30余篇,其中IF>10文章20余篇,包括Nat Genet、Cell Res、Cancer Res (2022, 2023)、Signal Transduct Target Ther (2021, 2022, 2023)、Nature Commun、Adv Sci (2020, 2022, 2025a&b)、Cell Discov、Oncogene、Cancer Commun、Acta Pharm Sin B等,系列工作多次被Nature、Science、Nature Cell Biology等引用。已授权中国专利19项,申请国际专利3项,2项专利已转让并进入临床研究。
担任香港大学医学院荣誉助理教授,在中国抗癌协会肿瘤转移专委会、低氧肿瘤生物学专委会、肿瘤标志专委会、中国病理生理学会蛋白质修饰与疾病专委会等国家级学会担任常委、秘书长等,担任Signal Transduct Target Ther、Acta Pharm Sin B等学术期刊编委。入选全球前2%顶尖科学家,获得广州市卫健委优秀人才等称号。

陈小兵 教授
医学肿瘤学博士、二级教授/主任医师、博士生硕士生导师、博士后合作导师
河南省肿瘤医院(中国医学科学院肿瘤医院河南医院)内科副主任兼病区主任
中国抗癌协会(CACA)第九届理事会理事、河南省科协十届委员会常委
国家健康科普专家、国务院特殊津贴专家、第九批河南省优秀专家
CACA食管肿瘤整合康复专委会主任委员、整合食管癌委员会副主任
科普中国《全面说食管癌》主编、CACA指南《食管癌篇》2025版副主编
《食管癌免疫检查点抑制剂临床应用全程管理专家共识》主编
《食管肿瘤整合康复患者指南2024版》《肿瘤整体评估》主编
中文与科技双核心期刊《中国医学前沿杂志(电子版)》编委
中国科技核心期刊《肿瘤综合治疗电子杂志》编委
河南省消化道肿瘤精准治疗工程技术研究中心主任
主持国自然面上、省自然重点项目、省杰青等课题20余项;国家癌症中心攀登基金2024年度Co-PI项目立项项目“基于电子患者报告结局的肿瘤营养管理在晚期食管癌一线免疫联合化疗中应用的随机对照研究”共同主持人;担任国家“十四五”重点图书《整合肿瘤学》临床卷《腹部盆腔肿瘤分册》主编,参与制定40余部国家规范、指南和专家共识;主编的《面对癌症:不恐慌不盲从》获科技部2020全国优秀科普作品奖、2023年中国抗癌协会科技奖科普奖。
来源:肿瘤界