2025年7月23日,上海交通大学医学院附属瑞金医院陈赛娟院士团队在Signal Transduction and Targeted Therapy(IF=52.7,Q1)杂志在线发表题名为“Molecular mechanisms of unique therapeutic potential of CUDC-907 for MEF2D fusion-driven BCP-ALL(CUDC-907治疗MEF2D融合基因驱动的急性前体B淋巴细胞白血病独特治疗潜能的分子机制研究)”的研究论文。

上海交通大学医学院附属瑞金医院/上海血液学研究所陈赛娟院士、国家儿童医学中心沈树红主任医师、上海交通大学医学院附属瑞金医院/国家转化医学中心(上海)张铭医师为论文的共同通讯作者;上海交通大学医学院附属瑞金医院/上海血液学研究所薛晴医师、上海交通大学医学院附属瑞金医院/国家转化医学中心(上海)张铭医师、国家儿童医学中心莫一啸医师、上海交通大学医学院附属瑞金医院/上海血液学研究所焦波副研究员、刘暄博士研究生为论文的共同第一作者。
急性前体B淋巴细胞白血病(BCP-ALL)是一种具有高度异质性的血液系统恶性肿瘤,其特征是淋巴母细胞在B细胞谱系分化过程中发生阻滞并克隆性增殖。虽然儿童BCP-ALL的治疗已取得显著进展,5年总生存率(OS)可达90%,但成人患者的预后仍不理想,长期生存率仅维持在50%左右。近年来,随着靶向治疗的发展,特定BCP-ALL亚型(如BCR::ABL1亚型)的治疗效果获得显著提升,特别是酪氨酸激酶抑制剂和造血干细胞移植(HSCT)的应用。与此同时,下一代测序技术的进步进一步细化了BCP-ALL的分子分型,新发现的疾病驱动基因为靶向药物的研发提供了重要线索。
前期,团队对203例BCP-ALL患者进行了基因表达谱的全景式分析,在国际上率先发现三组重现性的融合基因:MEF2D融合、ZNF384融合与DUX4-IGH融合基因,这三组融合基因各自具有独特的表达谱特征、免疫学表型并且分别对应高危、中危、低危三种预后(Liu et al, EbioMedicine, 2016)。团队进一步深挖其中预后最差的MEF2D融合基因的致病机制并对其靶向治疗方案进行了探索。在前期研究中,团队首次构建了MEF2 D-HNRNPUL1(MH)融合的条件性基因敲入小鼠模型,证明了MH融合基因显著阻滞B细胞的分化发育。进一步证实MH 融合基因可协同NRASG12D突变,加速急性B淋巴细胞白血病的发生。在体内证明了MH融合不仅是B细胞发育的重要调控因子,也是白血病发生的关键驱动因素(Zhang et al, BLOOD,2022)。MEF2D融合基因亚型以Pre-B细胞的克隆性扩增为特征,临床预后极差:儿童患者5年OS仅为33.3%,成人患者更低至15.6%,目前已被NCCN指南列为高危亚型。这类患者对常规化疗方案和HSCT的治疗效果不佳,亟需开发针对性的治疗策略。
基于团队前期的系列研究,本研究通过整合分子生物学、细胞和动物等多个层面,系统分析了MEF2D融合基因在白血病发生中的作用,揭示了MEF2D相关融合基因共同调控的关键通路。通过RNA-Seq、ChIP-Seq分析等,团队发现PI3K-AKT信号通路、HDAC9以及BCL2的异常激活在维持MEF2D融合基因阳性BCP-ALL细胞存活中发挥了关键作用。团队分别利用携带MH融合的细胞系和MB融合的体外模型,对包含5512种化合物的文库进行了高通量筛选。其中,CUDC-907作为一种靶向PI3K和HDAC的双重抑制剂,展现出显著的治疗潜力。实验证实,CUDC-907能选择性诱导MEF2D融合基因阳性细胞凋亡、下调pre-BCR表达并抑制白血病细胞增殖。通过SPR实验证明CUDC-907对PI3Kα和HDAC9具有很强的结合亲和力。CUDC-907通过双重调控机制作用于MEF2D融合基因相关的信号网络:一方面抑制PI3K-CREB通路及其下游融合基因的表达,另一方面调控MEF2D融合蛋白与HDAC轴介导的转录活性。在携带不同MEF2D融合基因的成人和儿童患者来源样本中,CUDC-907均表现出显著的体外抗肿瘤活性。此外,在MH/NRASG12D BCP-ALL基因敲入小鼠模型以及MB患者来源的异种移植模型(PDX)中,CUDC-907的疗效和安全性均得到了验证,其单药治疗效果优于单用传统化疗药物,当与化疗药物联用时,达到最佳疗效。
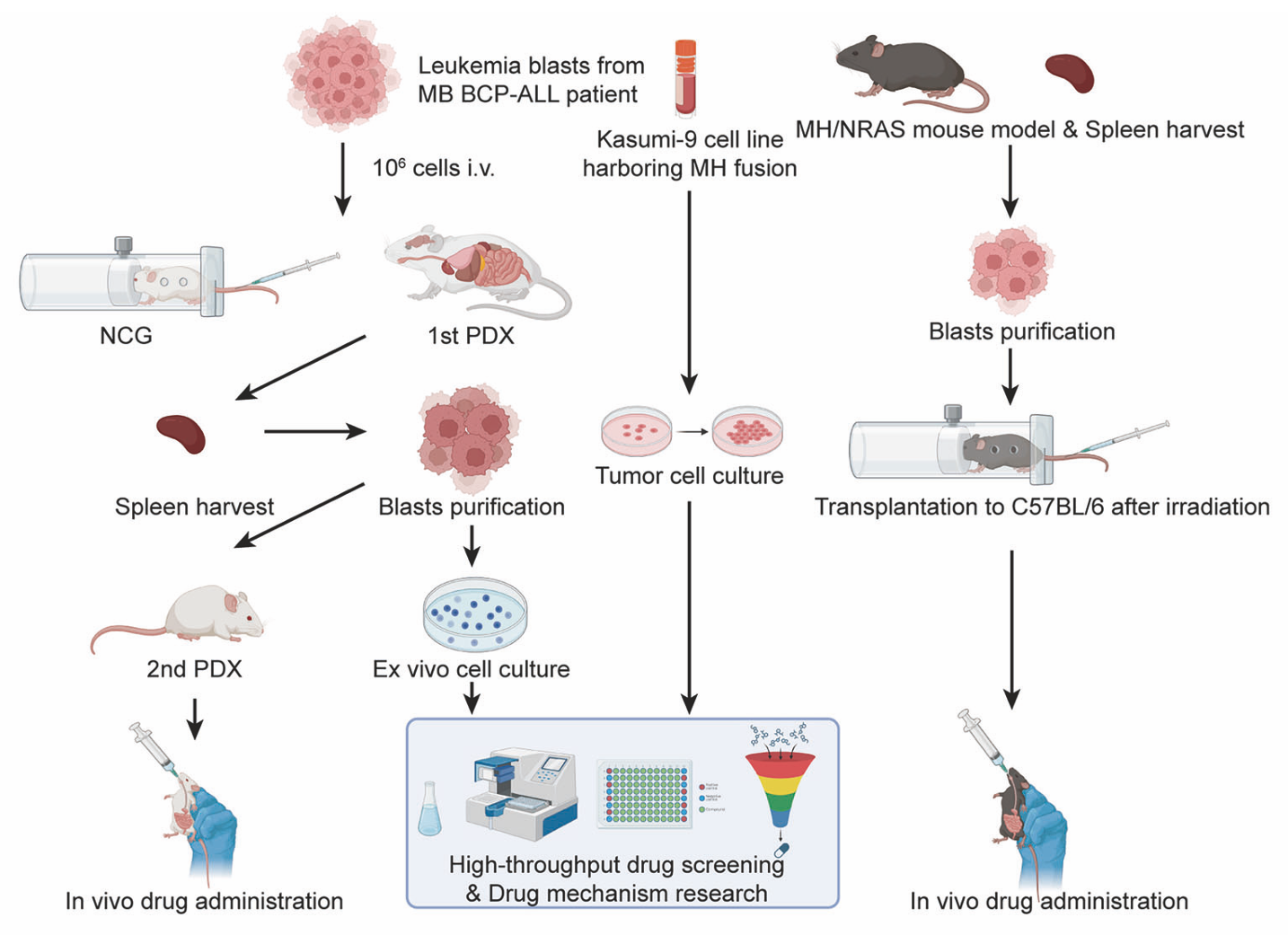
该研究通过高通量药物筛选和分子机制解析,揭示了CUDC-907作为PI3K/HDAC双靶点抑制剂在MEF2D融合基因驱动的BCP-ALL中的独特疗效。CUDC-907能同时抑制PI3K/HDAC两条通路,破坏致癌反馈循环,为融合基因相关白血病的精准治疗提供了新靶点和理论依据。
该研究揭示了双靶点抑制药物在MEF2D融合基因阳性BCP-ALL治疗中的潜在价值,并表明CUDC-907有望成为针对此类融合基因驱动型白血病的精准治疗候选药物,并可能推广至其他相似通路依赖的血液肿瘤,具有重要的临床转化价值。
作者介绍
陈赛娟 中国工程院院士,博士生导师,上海交通大学医学院附属瑞金医院终身教授,国家转化医学研究中心(上海)主任,组学与疾病全国重点实验室主任,上海血液学研究所名誉所长,现任中华医学会副会长
研究方向:血液恶性疾病发病机制和新型靶向治疗研究
焦波 副研究员,上海交通大学医学院附属瑞金医院,上海血液学研究所
研究方向:血液肿瘤发病机制研究与靶向药物研发
薛晴 医师,上海交通大学医学院附属瑞金医院,上海血液学研究所
研究方向:白血病发病机制与靶向治疗研究
张铭 医师,上海交通大学医学院附属瑞金医院国家转化医学中心(上海)
研究方向:白血病发病机制及靶向治疗研究
刘暄 博士研究生,上海交通大学医学院附属瑞金医院,上海血液学研究所
研究方向:白血病发病机制及靶向治疗研究
来源:上海血液学研究所