2025年8月6日,中国人民解放军总医院徐建明教授团队在 Signal Transduction and Targeted Therapy 在线发表题为“Finotonlimab (PD-1 inhibitor) plus bevacizumab (bevacizumab biosimilar) as first-tier therapy for late-stage hepatocellular carcinoma: a randomized phase 2/3 trial”的研究论文。该项II/III期随机临床试验(ClinicalTrials.gov,NCT04560894;Chinadrugtrials.org.cn,CTR20201976和CTR20201974)在中国67家中心开展,评估了菲诺利单抗(一种程序性死亡受体-1[PD-1]抑制剂)联合SCT510(一种贝伐珠单抗生物类似药)治疗不可切除的晚期肝细胞癌(HCC)的耐受性和疗效,并与索拉非尼进行了对比。

根据GLOBOCAN 2022年数据,HCC新发病例在中国癌症发病率中位列第四,是癌症相关死亡的第二大原因。HCC通常症状隐匿,超过70%的患者确诊时已处于中晚期。此外,患者术后5年内复发率高达70%。多数复发患者已错失手术时机,因此对于不可切除的HCC,系统性治疗已成为主流方案。
索拉非尼的中位总生存期(mOS)不足一年,但长期以来一直是全球晚期HCC的一线标准治疗。一项非劣效性研究显示,靶向血管内皮生长因子受体(VEGFR)、成纤维细胞生长因子受体(FGFR)和血小板衍生生长因子受体(PDGFR)的仑伐替尼治疗HCC的总生存期(OS)为13.6个月,较索拉非尼(12.3个月)显著提升。基于此结果,仑伐替尼成为第二个获批的靶向治疗药物。随着生物制剂的发展,免疫检查点抑制剂(ICIs)在HCC治疗中展现出疗效,但单药治疗的疗效仍显有限。鉴于血管内皮生长因子(VEGF)在调控癌症免疫反应中的作用,使用抗体靶向VEGF可能增强免疫治疗效果。IMbrave150研究表明,阿替利珠单抗(一种程序性死亡配体1[PD-L1]抑制剂)联合贝伐珠单抗(抗VEGF抗体)治疗晚期HCC,可显著改善生存率且安全性良好。
尽管已有多项III期临床试验探索了ICIs联合贝伐珠单抗或酪氨酸激酶抑制剂(TKIs)治疗晚期HCC的协同效应,但当时仅阿替利珠单抗与贝伐珠单抗联合方案获得批准。然而在中国,当时尚未有PD-1抑制剂联合抗VEGF药物的临床应用获批。因此,在本试验启动时,中国患者的治疗选择较为有限。目前,信迪利单抗(PD-1抑制剂)联合贝伐珠单抗生物类似药(抗VEGF)(ORIENT-32研究)以及卡瑞利珠单抗(PD-1抑制剂)联合阿帕替尼(TKI)(CARES-310研究)的方案已在中国获批。同时,尽管尚未在国内获批,但指南已推荐ICIs联合疗法作为晚期肝癌的一线治疗方案,例如HIMALAYA研究和CheckMate-9DW研究。
菲诺利单抗(SCT-I10A)是一种靶向PD-1的人源化免疫球蛋白G4单克隆抗体,已在小鼠模型和患者中均展现出抗肿瘤活性。该药物在多种癌症治疗中表现出高效性且安全性良好。本文重点介绍了一项II/III期临床试验结果,评估了菲诺利单抗联合贝伐珠单抗生物类似药SCT510治疗晚期HCC的疗效及耐受性。
在2020年11月11日至2022年9月28日期间,共筛选609例患者(II期81例,III期526例),排除202例后,最终纳入398例HCC患者(II期研究52例,III期研究346例)。
II期研究中,患者接受菲诺利单抗(200 mg,每3周一次)联合SCT510(15 mg/kg,每3周一次)治疗。III期研究中,患者按2:1的比例随机分配至菲诺利单抗联合SCT510(双药)组或索拉非尼组。中位随访时间为19.7个月(双药组为19.9个月,索拉非尼组为19.0个月)。
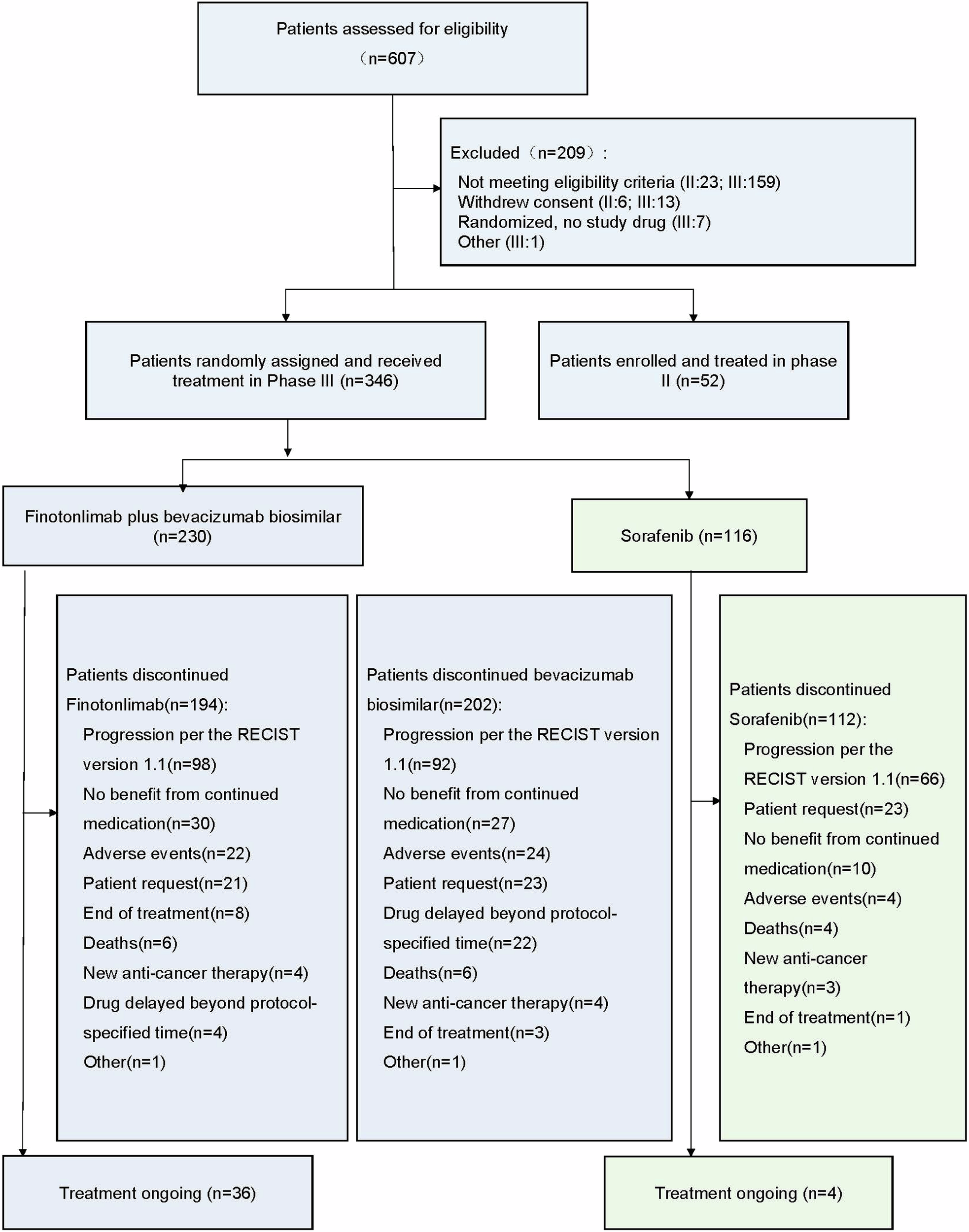
试验概况
研究结果显示,与索拉非尼组相比,双药组患者的中位无进展生存期(mPFS)显著延长。双药组的mPFS为7.1个月(95%CI:6.1-8.4),索拉非尼组为2.9个月(95%CI:2.8-4.1)(分层风险比[HR]=0.50,95%CI:0.38-0.65,P< 0.0001)。
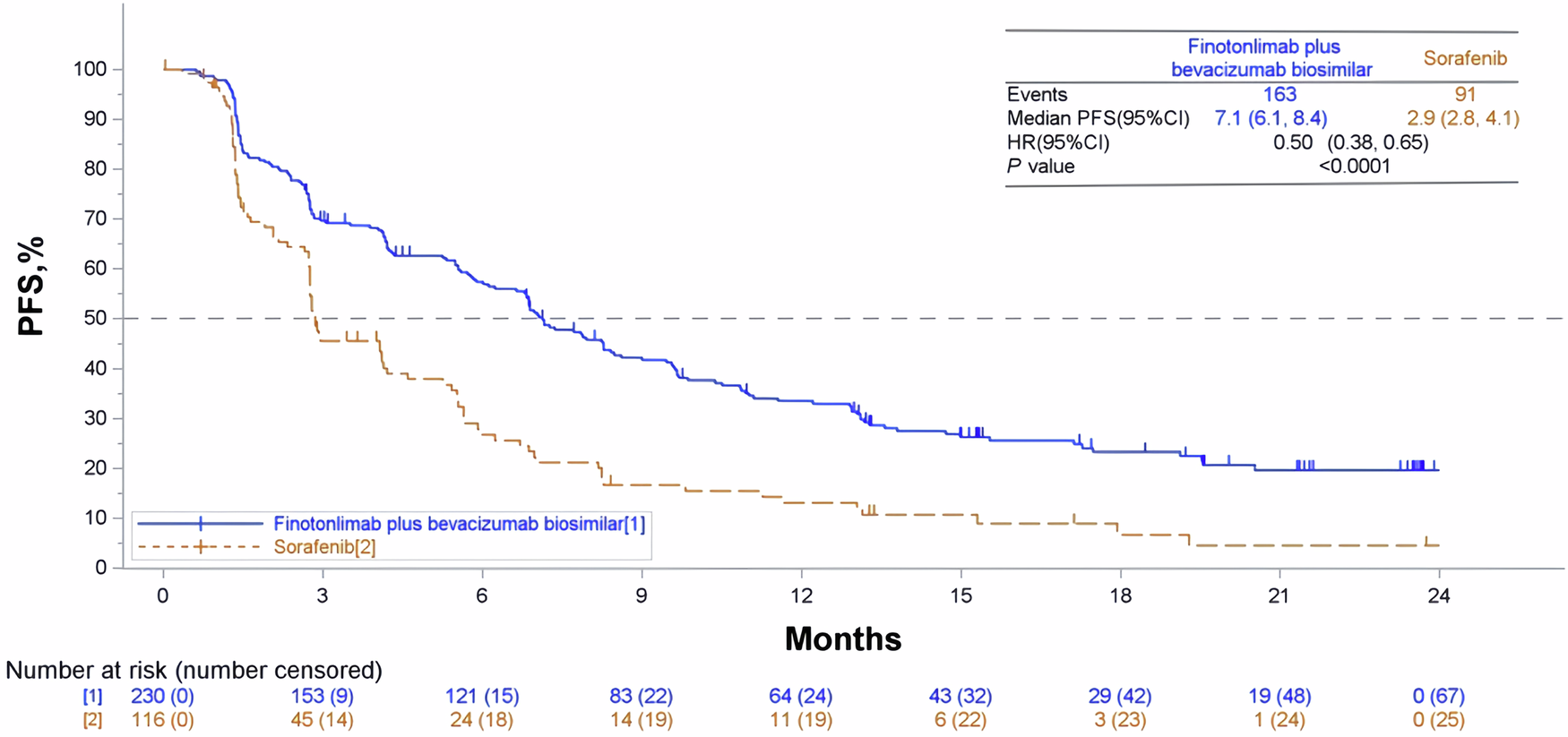
BICR 评估的PFS的Kaplan-Meier 曲线
双药组的中位总生存期(mOS)为22.1个月(95%CI:18.6,NR),索拉非尼组为14.2个月(95%CI: 10.2-15.8)(HR=0.60,95%CI: 0.44-0.81,P< 0.0008)。与索拉非尼相比,双药方案显著延长了OS,死亡风险降低了40%。双药组与索拉非尼组的1年、1.5年和2年生存率分别为66.8% vs 55.2%、57.0% vs 38.5%和49.9% vs 36.8%。双药组表现出更高的生存率,提示持续的生存获益。
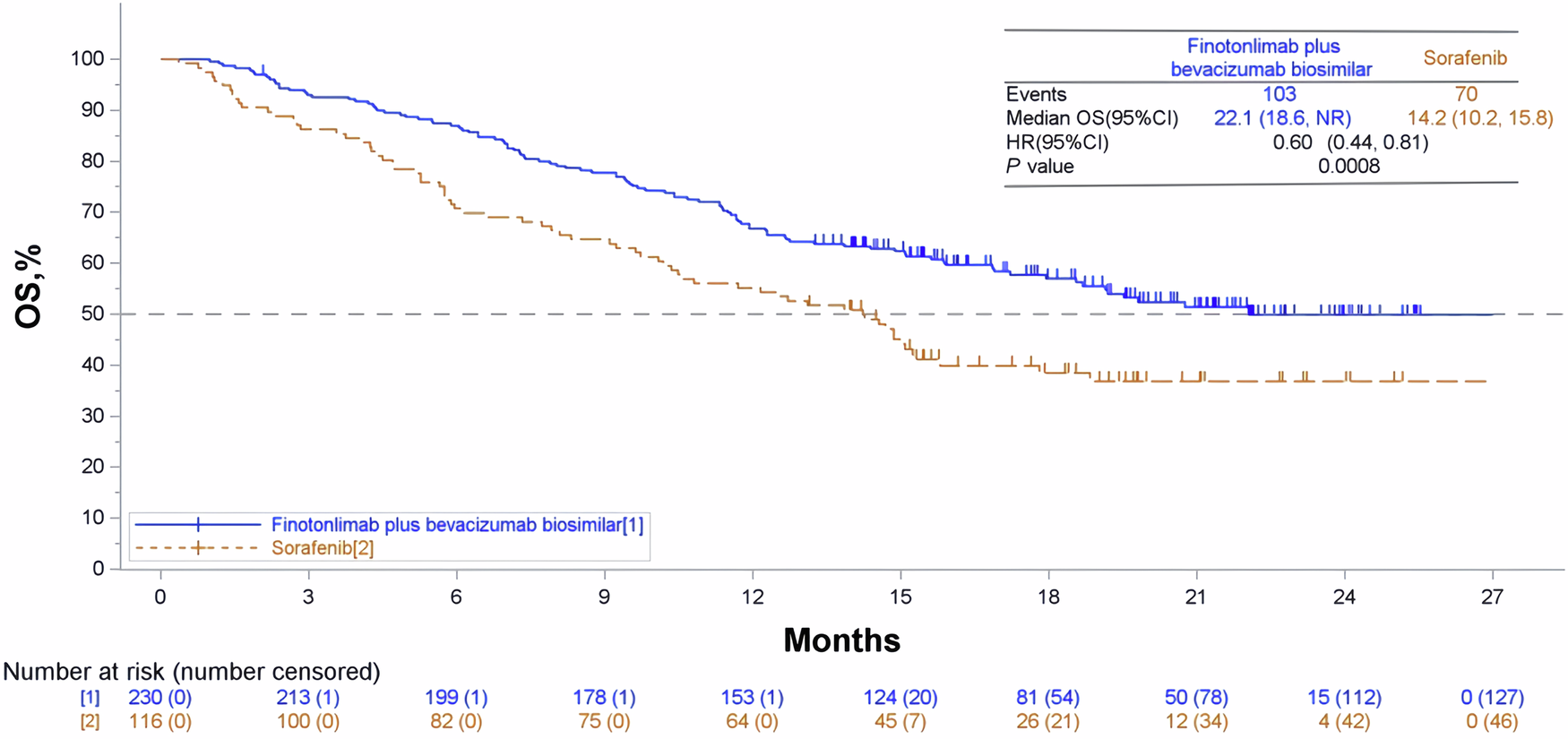
OS 的 Kaplan-Meier 曲线
安全性方面,双药组223例患者(97.0%)和索拉非尼组108例患者(93.1%)发生了治疗相关不良事件(TEAE)。两种方案的TEAE发生率均≥10%。其中,双药组121例患者(52.6%)和索拉非尼组44例患者(37.9%)发生了≥3级TEAE。发生率≥5%的≥3级TEAE包括:血小板计数减少 [双药组:16例(7.0%); 索拉非尼组:3例(2.6%)]、蛋白尿[双药组:15例(6.5%); 索拉非尼组:1例(0.9%)]、掌跖红斑感觉障碍综合征[双药组:0例; 索拉非尼组:8例(6.9%)]和高血压[双药组:20例(8.7%); 索拉非尼组:5例(4.3%)]。
双药组发生严重不良事件(SAE)的比例高于索拉非尼组 [67例(29.1%) vs 15例(12.9%)]。双药组报告了7例(3.0%)TEAE相关死亡[1例肝性脑病,1例颅内出血,1例副肿瘤综合征,1例心力衰竭,1例上消化道出血,2例不明原因死亡],索拉非尼组报告了2例(1.7%)[1例不明原因,1例肝细胞癌破裂]。双药组有121例患者出现免疫相关不良事件(irAE),其中28例(12.2%)为≥3级。此外,23例患者(10.0%)发生了导致治疗中断的irAE,11例患者(4.8%)发生了导致停药的事件,未发生导致死亡的irAE。
综上,菲诺利单抗联合SCT510作为HCC一线治疗显示出显著的疗效。主要终点PFS和OS均达到预设的统计学标准,主要分析显示具有统计学和临床意义上的显著获益。双药方案的安全性可控,未发现非预期或不可控的安全信号。
参考文献
Zhao, C., Zhang, Y., Wang, G. et al. Finotonlimab (PD-1 inhibitor) plus bevacizumab (bevacizumab biosimilar) as first-tier therapy for late-stage hepatocellular carcinoma: a randomized phase 2/3 trial. Sig Transduct Target Ther 10, 249 (2025). https://doi.org/10.1038/s41392-025-02333-5.
来源:肿瘤界