2025年8月7日,香港中文大学于君教授团队在Cancer Cell发表题为“Tumor-resident probiotic Clostridium butyricum improves aPD-1 efficacy in colorectal cancer models by inhibiting IL-6-mediated immunosuppression”的研究论文。该研究首次揭示丁酸梭菌通过secD/GRP78/IL-6轴重塑肿瘤免疫微环境,显著增强PD-1抑制剂对MSS型结直肠癌的疗效,为克服ICB耐药提供了靶向干预新策略。

结直肠癌是全球第三大高发恶性肿瘤,癌症相关死亡率高居第二。免疫检查点阻断(ICB)疗法,如靶向PD-1/PD-L1的治疗,虽在微卫星不稳定型(MSI-H)结直肠癌中疗效显著,但约85%患者属于微卫星稳定型(MSS),其肿瘤免疫原性低导致ICB响应不佳,临床亟需新型增效策略。
近年来,肠道菌群在调控肿瘤免疫微环境、影响ICB疗效的作用备受关注。丁酸梭菌(Clostridium butyricum)作为一种产芽孢的肠道益生菌,在结直肠癌患者体内丰度显著降低,且临床研究提示其口服补充可增强晚期肾癌患者的ICB响应,这提示它可能在结直肠癌免疫治疗中发挥重要作用。
研究首先通过多队列宏基因组分析证实,结直肠癌患者粪便中丁酸梭菌的丰度显著低于健康人群,且ICB响应者的丁酸梭菌丰度高于非响应者。团队从健康成人粪便中分离的丁酸梭菌新菌株Hkyucb11,其与商用菌株C.b19398在体外可显著抑制结直肠癌细胞增殖,诱导细胞凋亡与G1/S期阻滞,且对正常结肠上皮细胞无毒性。患者来源的结直肠癌类器官亦验证了该抑癌作用。
研究团队通过ApcMin/+自发结直肠癌模型、AOM/DSS诱导以及原位移植瘤(MSI-H型MC38和MSS型CT26)模型证实,丁酸梭菌单独灌胃即可显著抑制肿瘤生长,联合PD-1抑制剂后,即使耐药MSS型肿瘤亦显示协同效应。
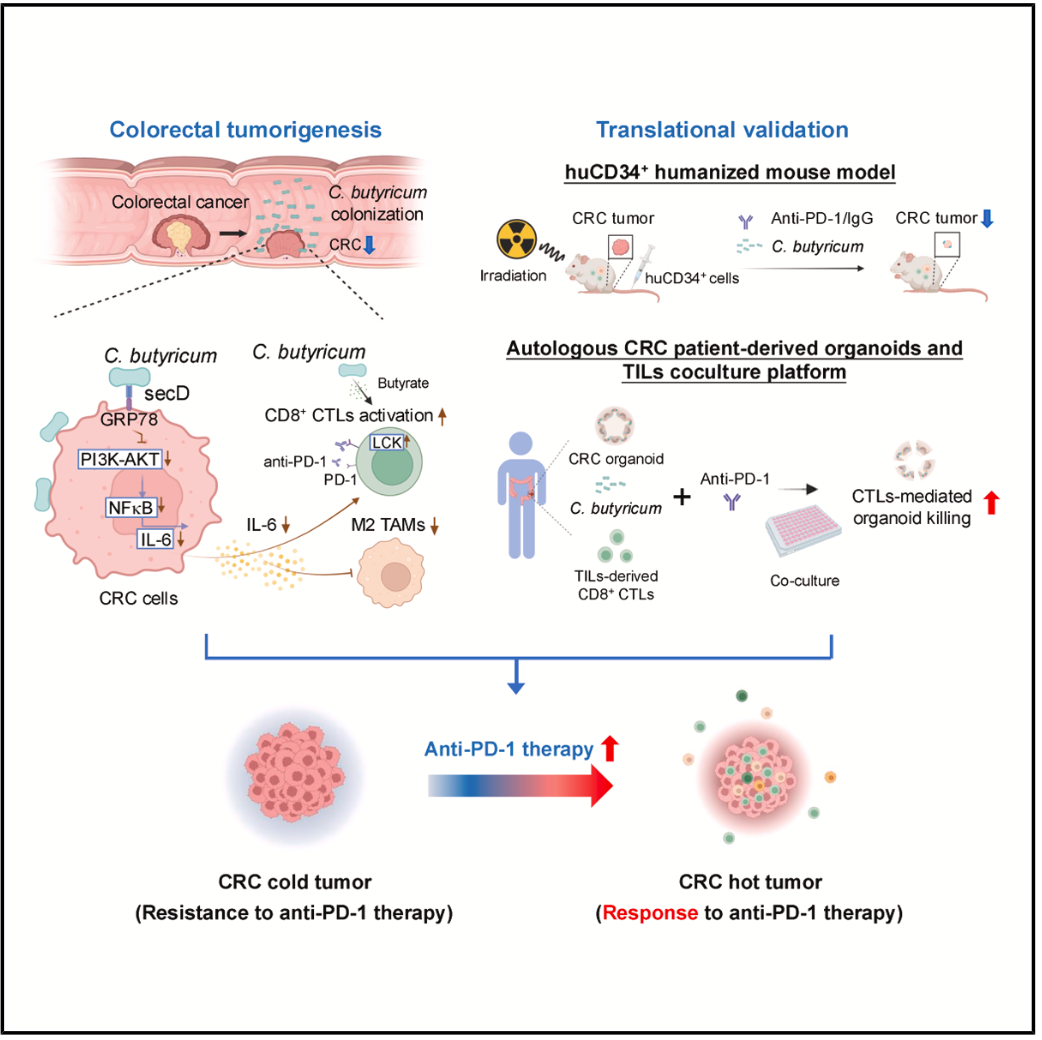
图文摘要
机制研究中,团队发现丁酸梭菌的核心作用依赖于其表面蛋白secD与结直肠癌细胞表面受体GRP78的特异性结合,该受体在癌细胞表面高表达而正常上皮细胞几乎不表达,这使得丁酸梭菌能精准靶向肿瘤细胞。secD-GRP78结合抑制下游PI3K/Akt-NF-κB信号通路,减少免疫抑制因子IL-6的分泌,从而解除对CD8+ T细胞的抑制,激活其T细胞受体信号通路,促进IFN-γ、TNF-α、granzyme B的释放,同时抑制肿瘤相关巨噬细胞(TAMs)向M2型极化,进一步改善免疫微环境。敲除结直肠癌细胞的GRP78,其增强抗PD-1疗效的作用完全消失,直接验证了secD/GRP78轴的关键作用。
为更接近临床,团队使用huCD34+免疫人源化小鼠模型和患者来源的结直肠癌类器官与自体肿瘤浸润T细胞共培养系统,进一步证实丁酸梭菌可显著增强肿瘤微环境中CD8+ T细胞的浸润及杀伤活性,与PD-1抑制剂联合时效果更显著,为临床转化提供了关键证据。
该研究首次阐明丁酸梭菌通过secD/GRP78/IL-6轴重塑肿瘤免疫微环境、增效免疫治疗的分子机制,为改善MSS型结直肠癌的ICB耐药提供了可供临床转化的联合治疗新策略。
来源:小柯生命