近年来,细胞免疫治疗已成为肿瘤学研究的前沿领域。其中,嵌合抗原受体T细胞(CAR-T)疗法以其在血液肿瘤中的显著疗效,被誉为“第四大抗癌武器”。然而,面对实体瘤异质性、免疫抑制微环境和T细胞耗竭等瓶颈,这一技术仍面临诸多挑战。
2025年8月25日,重庆大学附属肿瘤医院肿瘤内科李咏生教授团队在生物医学顶刊Advanced Science(IF:14.1)发表了题为“From Bench to Bedside: Emerging Paradigms in CAR-T Cell Therapy for Solid Malignancies”的综述文章。该论文总结了CAR-T疗法在实体瘤研究中的困境与机遇,提出了从新抗原发现、合成生物学优化到跨学科组合的前沿突破,为推动实体瘤免疫治疗的临床转化提供了重要思路。

CAR-T疗法在实体瘤中的挑战
CAR-T细胞治疗通过基因工程手段改造患者自身的T细胞,使其表面表达人工设计的嵌合抗原受体(CAR),从而赋予T细胞精准识别和杀伤肿瘤细胞的能力。这一疗法在多种血液系统恶性肿瘤中取得了革命性突破,并且多款CAR-T已在全球上市。然而,在实体瘤中,CAR-T疗法仍处于临床试验探索阶段,面临着许多挑战,如:肿瘤异质性、免疫抑制微环境、免疫细胞持久性有限和功能衰竭、细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)等不良反应、制造复杂和效率低(图1)。
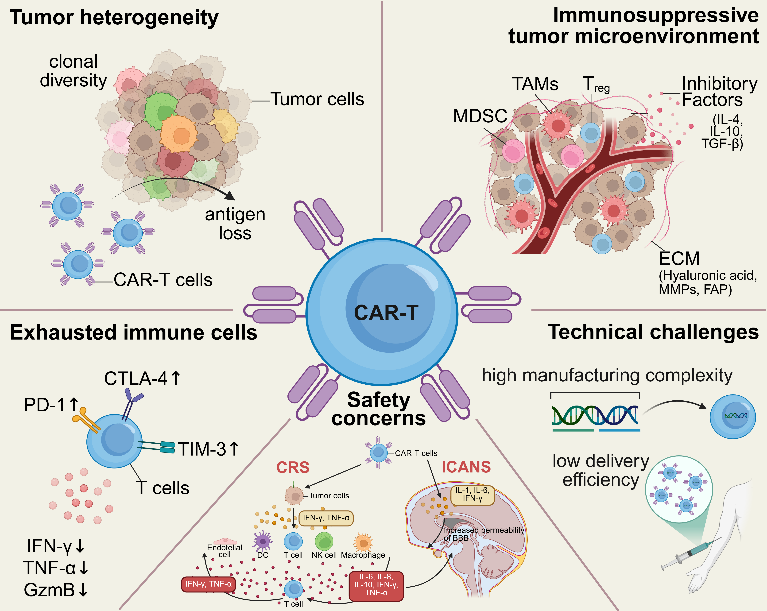
图1. CAR-T治疗实体瘤的五大困境
多学科技术联合助力CAR-T突围
CAR-T治疗实体瘤的关键是靶点的选择,目前常用的靶点有HER2、EGFR、GPC3和Claudin18.2,但效果有限。肿瘤微环境(TME)中的细胞外基质、免疫抑制细胞、免疫检查点分子和细胞因子在肿瘤细胞的存活和耐药性的发展中起着关键作用,是潜在的新靶点。但值得注意的是,在实体瘤的治疗过程中,TME的基因和表观遗传改变进一步推动了治疗耐药性(图2)。
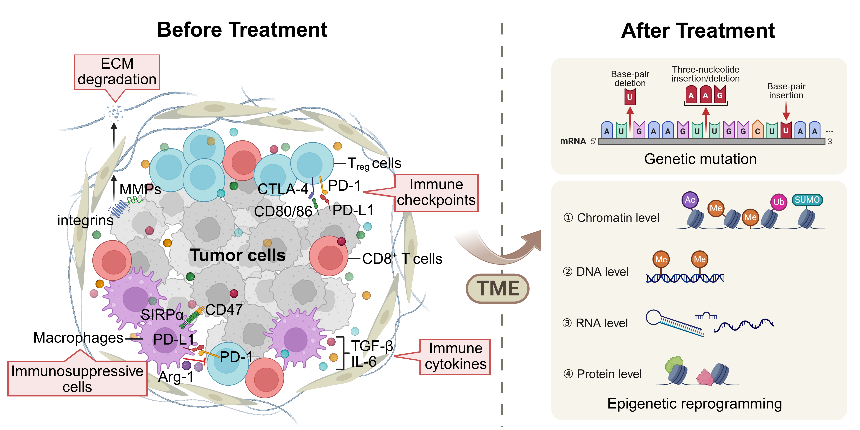
图2. TME中的潜在靶点以及CAR-T治疗后的基因和表观遗传重塑
为了突破上述困境,多种跨学科技术促进CAR-T细胞工程新抗原的发现。这些技术主要包括(图3、表2):
合成生物学:光遗传学(蓝光开关)、聚焦超声(深部激活)、小分子调控系统(如Dox诱导)为CAR-T提供了时空可控性。
逻辑门控:AND、OR、NOT、IF-THEN、IF-BETTER、自杀基因开关等设计让CAR-T具备“多条件决策”的能力,大幅提升了特异性与安全性。
AI驱动蛋白:传统CAR使用的scFv稳定性有限,AI工具(如RFdiffusion)正推动新型抗原结合结构域设计。
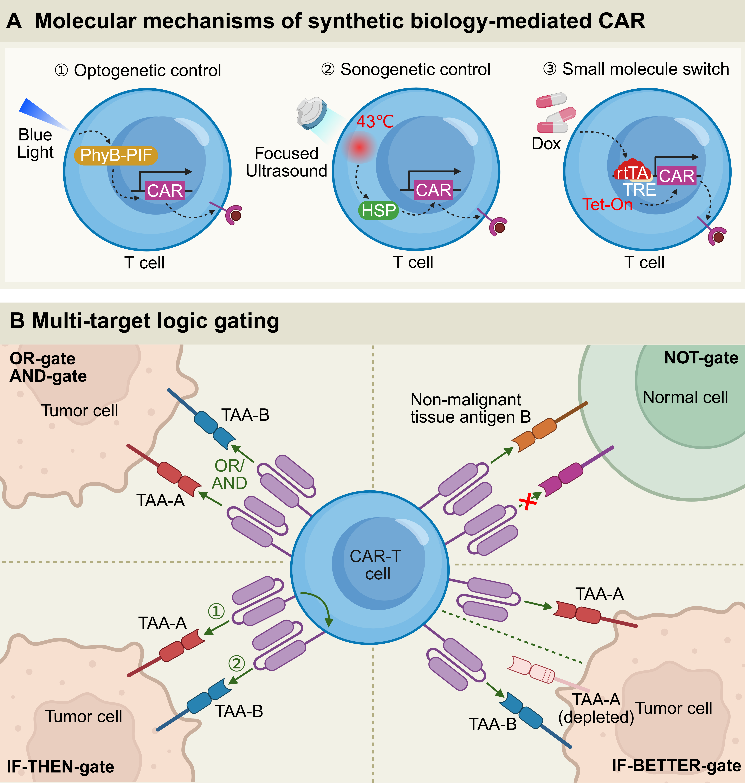
图3. 合成生物CAR-T细胞活性的策略
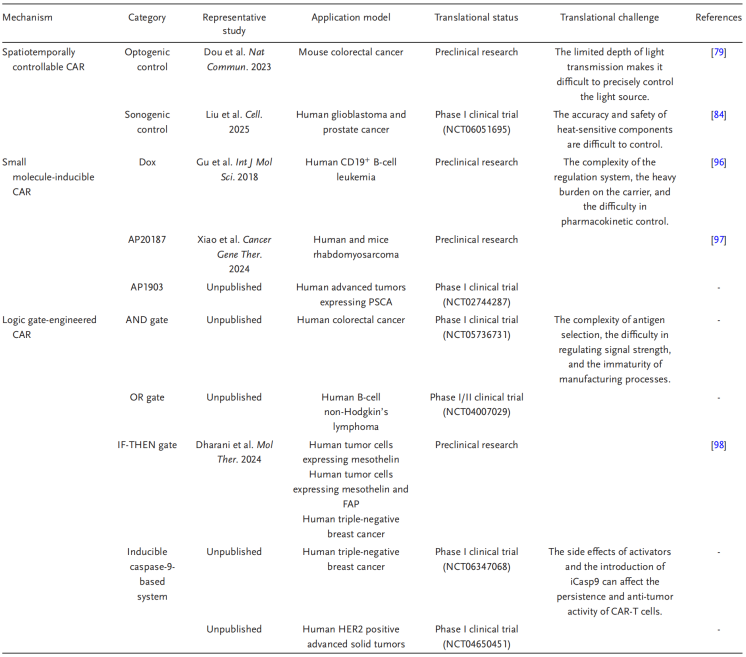
表1. 基于合成生物学改造CAR-T的从基础到临床的研究进展
跨学科技术不仅停留在CAR本身设计,还延伸到改善其在免疫抑制微环境中的功能。例如,将TGF-βRII胞外段与IL-15Rα胞内段融合的受体结构插入设计,IL-10过表达的细胞因子改造,肿瘤靶向元件(BCMA scFv)与免疫调节细胞因子受体(IL-15Rα和IL-2R)的融合设计(图4)。这些尝试表明,通过精准调控TME信号和细胞因子回路,CAR-T的功能和持久性有望获得大幅提升。
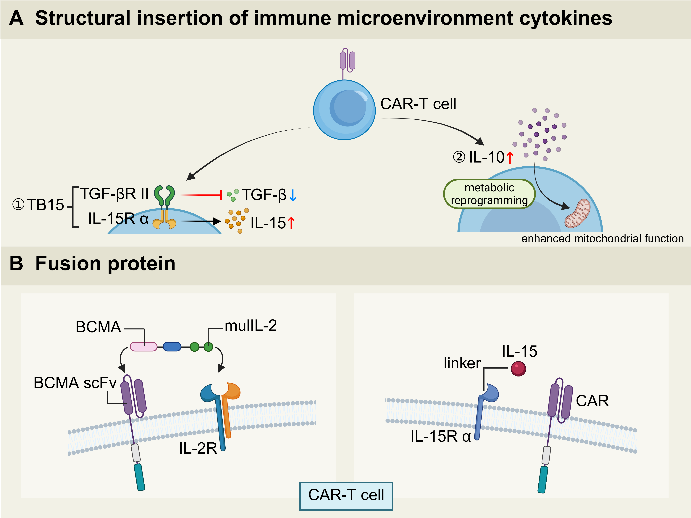
图4. 调节肿瘤免疫微环境提高CAR-T细胞疗效的策略
CAR-T疗法在实体瘤治疗中的临床进展
尽管CAR-T治疗实体瘤困难重重,但近年来在临床的实践中已经展开了一系列探索。在给药路径方面,脑胶质瘤采用脑室注射,肝癌通过动脉灌注,结直肠癌尝试腹腔给药,均能提升局部疗效。另外,联合疗法正成为CAR-T探索的重要方向:CAR-T联合免疫检查点抑制剂(如PD-1/PD-L1、CTLA-4抑制剂)能提升CAR-T的功能和持久性;CAR-T与CAR-NK/CAR-M协同,发挥多细胞优势;CAR-T与病毒或靶向药物结合,共同突破TME屏障(图5、表2)。
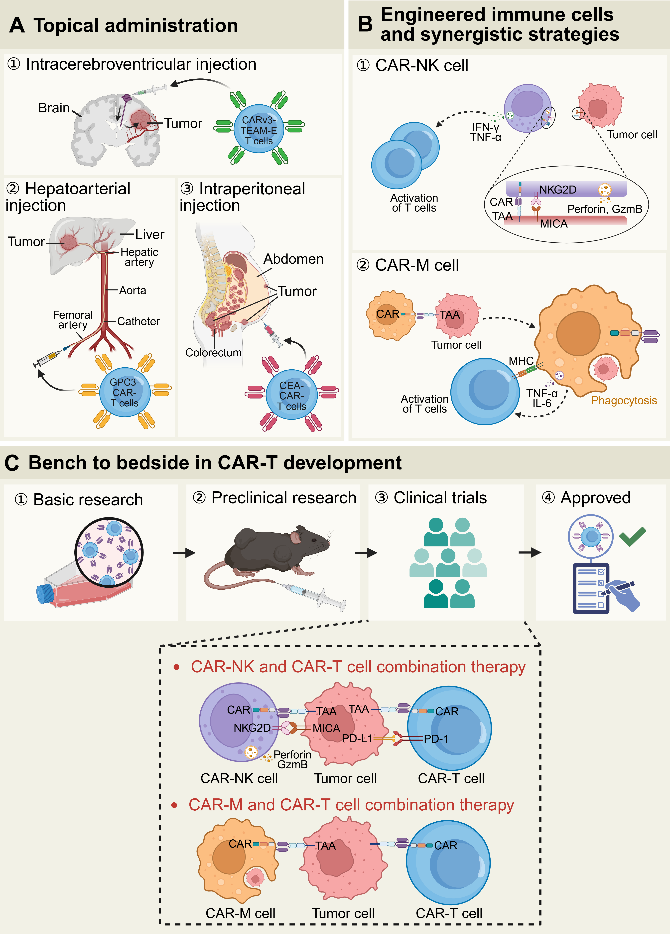
图5. CAR-T局部给药、工程免疫细胞策略和CAR-T治疗的临床转化路线
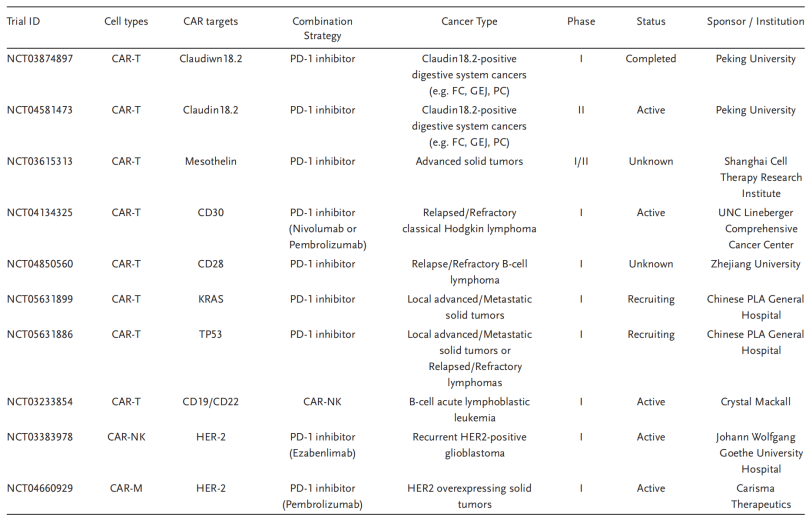
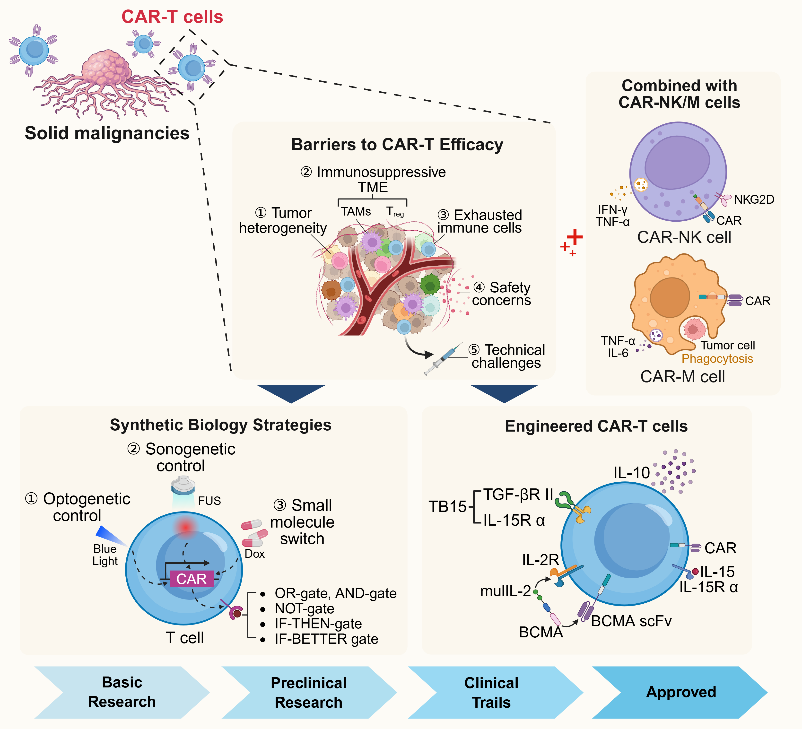
表2. CAR-T联合PD-1/PD-L1抑制剂或CAR-NK/CAR-M的临床试验
总结与展望
这篇综述探讨了CAR-T疗法在实体瘤中的五大难题,全面而系统地剖析了跨学科技术赋能的新格局。随着合成生物学、人工智能等前沿手段的深度融合,使CAR-T细胞正从单一的免疫工具演变为“可编程的活药物”,有望在未来为实体瘤免疫细胞治疗开辟新纪元。
图6. CAR-T疗法的困境与突破
重庆大学附属肿瘤医院肿瘤内科主治医师陈洋为本文第一作者,重庆大学博士研究生任然为本文共同第一作者,李咏生教授为本文通讯作者。中国医科大学附属第一医院肿瘤内科闫泓霏教授为本文共同通讯作者。
作者简介
第一作者

陈 洋
重庆大学附属肿瘤医院肿瘤内科主治医师,医学博士,重庆大学生物医学工程博士后,重庆市中青年医学高端人才,主要研究方向为肿瘤免疫与代谢。
近5年以第一作者发表中科院1区SCI论文4篇,参与发表SCI论文15篇,累计影响因子大于100。主持国家自然科学基金青年项目1项,获批重庆市博士后特别资助、留渝资助各1项,参与国家科技部重大专项(子课题)、国家自然科学基金面上项目、重庆市科卫联合重点项目及重庆市自然科学基金面上项目等5项。
共同第一作者

任 然
重庆大学在读博士研究生。主要从事肝细胞癌恶性进展和非小细胞肺癌靶向药药代动力学的研究。
以第一/共同第一作者在Advanced Science、Cancer Immunology Research、Genes & Diseases、Cell Death Discovery、MedComm-Oncology等杂志发表SCI论文5篇,主持及参与重庆市研究生科研创新项目各1项,获2024年中国抗癌协会CACA研究生肿瘤基础与临床创新大会优秀论文一等奖、重庆大学第九届互联网+大学生创新创业大赛校赛铜奖、重庆大学优秀毕业生。
通讯作者

李咏生
重庆大学附属肿瘤医院肿瘤内科(国家临床重点专科)主任、临床研究病房(I期病房)主任、主任医师、博士生导师,美国哈佛医学院博士后、国家中组部海外高层次引进人才,中国高被引学者、重庆英才-创新领军人才、重庆市学术技术带头人。
专注“脂代谢重编程与肿瘤微环境”研究领域,担任国家自然科学基金重点国际合作项目首席科学家,国家重点研发计划、国自然基金重点、国合、优青、海优评审专家。
中国抗癌协会青年理事会副理事长,中国抗癌协会整合肿瘤学分会秘书长,重庆市中青年医学卓越团队负责人,重庆市高校创新研究群体负责人等。获得中国抗癌协会青年科学家奖、中国细胞生物学学会青年科学家奖、重庆市科技进步一等奖、中国抗癌协会科技奖二等奖、重庆市自然科学二等奖、中国临床肿瘤学会首批“最具潜力青年肿瘤医生” 、树兰医学青年提名奖等。
主持国家自然科学基金重点国际合作研究项目、重庆市杰出青年科学基金、国家临床重点专科项目等课题20余项,牵头和参研国际和全国多中心临床试验100余项。担任STTT等杂志编委、Cell Metabolism、Advanced Science等杂志审稿人。发表高水平SCI论文100余篇,总影响因子大于800,单篇影响因子大于10的论文40余篇。主/参编著作8部,获得国际和国家发明专利7项。
来源:重庆肿瘤防治