2025年9月5日,上海市胸科医院李志刚教授团队在Cell Reports Medicine上发表了全球首个食管癌新辅助围手术期分子残留病灶(molecular residual disease,MRD)临床应用策略的研究成果,题为“ctDNA detects residual disease after neoadjuvant chemoradiotherapy and guides adjuvant therapy in esophageal squamous cell carcinoma”。该研究首次将基于循环肿瘤DNA(ctDNA)的MRD检测整合至食管癌新辅助围手术期管理,证实了MRD在术前精准筛选保器官对象与术后风险分层指导辅助治疗中的双重临床价值,为食管癌的精准适应性治疗提供了新的视角和有力工具。通讯作者为上海市胸科医院李志刚教授和李春光副主任。

研究背景
食管癌是全球癌症相关死亡的第七大原因,其中食管鳞状细胞癌(ESCC)约占90%。局部晚期ESCC的标准治疗是新辅助放化疗(nCRT)联合手术。然而,约40%的患者在nCRT后可达到病理完全缓解(pCR),这使得对所有患者进行标准食管切除术的必要性受到质疑。因此,为避免过度治疗,临床提出“观察等待”(Watch and Wait)的器官保留策略,仅对 nCRT后无残余病灶(临床完全缓解,cCR)的患者进行主动监测。
然而,当前临床反应评估(CRE)主要依赖内镜活检和超声内镜引导下细针穿刺,其在检测MRD方面存在显著局限性。欧洲preSANO试验显示,传统CRE在检测任何残留病灶(≥1%存活肿瘤细胞)时有23%的假阴性率,亚洲preSINO研究中也观察到18.3%的假阴性率。因此,亟需更敏感的生物标志物以提升残留病灶的检测能力。
循环肿瘤DNA(ctDNA)作为一种新兴的液体活检技术,已在多种实体瘤中显示出检测MRD和预测复发的潜力。然而,其在食管癌新辅助治疗后的应用尚不充分,尤其是在指导器官保留策略和术后辅助治疗方面仍存在两大关键问题:一是ctDNA能否提升残留病灶检测的准确性;二是术后ctDNA能否指导辅助免疫治疗的使用。
研究设计
该研究是食管鳞癌新辅助放化疗后疗效评估诊断试验(preSINO研究)的探索性终点分析。研究纳入132例局部晚期食管鳞癌患者,分别在基线、新辅助治疗结束后的临床反应评估节点1(CRE-1新辅助治疗结束后4-6周)、新辅助治疗结束后的临床反应评估节点2(CRE-2新辅助治疗结束后10-12周)、术后3–4周、术后3–6个月等节点收集血液样本,进行基于ctDNA的MRD检测。具体研究设计如下图所示,研究者头对头比较了当下三种主流ctDNA检测技术路线的性能,并评估ctDNA检测在疗效评估中单独与联合应用的价值,分析ctDNA检测对复发风险预测及指导辅助治疗的价值。
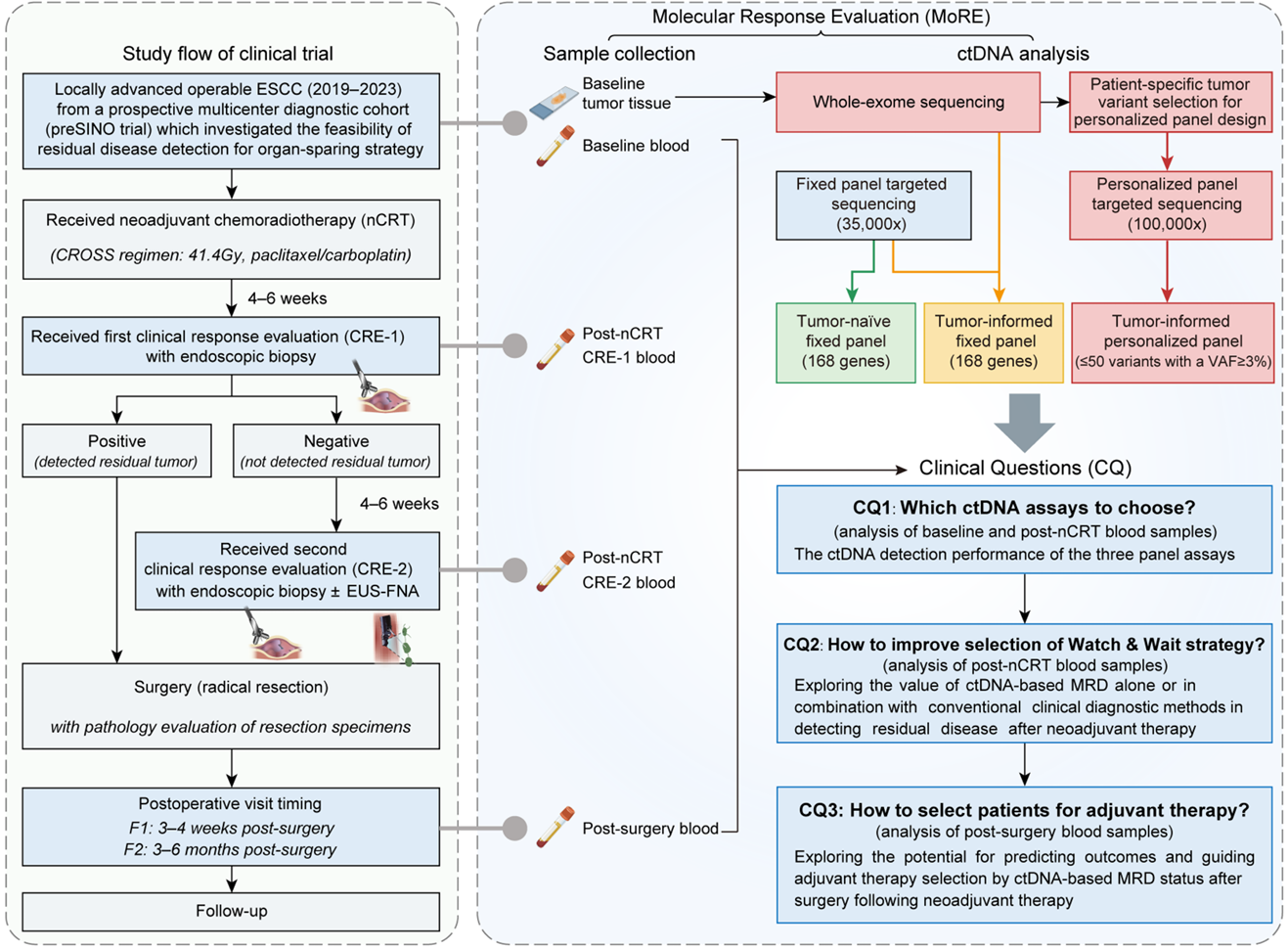
研究设计
研究结果
ctDNA检测方法比较:个性化定制panel最优
本研究首次于食管癌领域对三种主流ctDNA检测技术路线进行了头对头比较:包括肿瘤未知(tumor-naive)固定化panel(不依赖肿瘤组织检测信息)、肿瘤知情(tumor-informed)固定化panel(基于肿瘤组织检测)、肿瘤知情个性化定制panel(基于WES)的三种ctDNA策略。
在基线时,肿瘤知情个性化定制panel的ctDNA阳性检出率显著高于其他两种方法(99.2% vs 91.2% vs 61.6%,P<0.001)。进一步分析显示,仅由个性化panel检出的患者其ctDNA分数显著更低,说明其在低水平ctDNA检测中更具优势。此外,99.5%的追踪变异为患者特有,凸显了ESCC的高度异质性和固定panel的局限性。
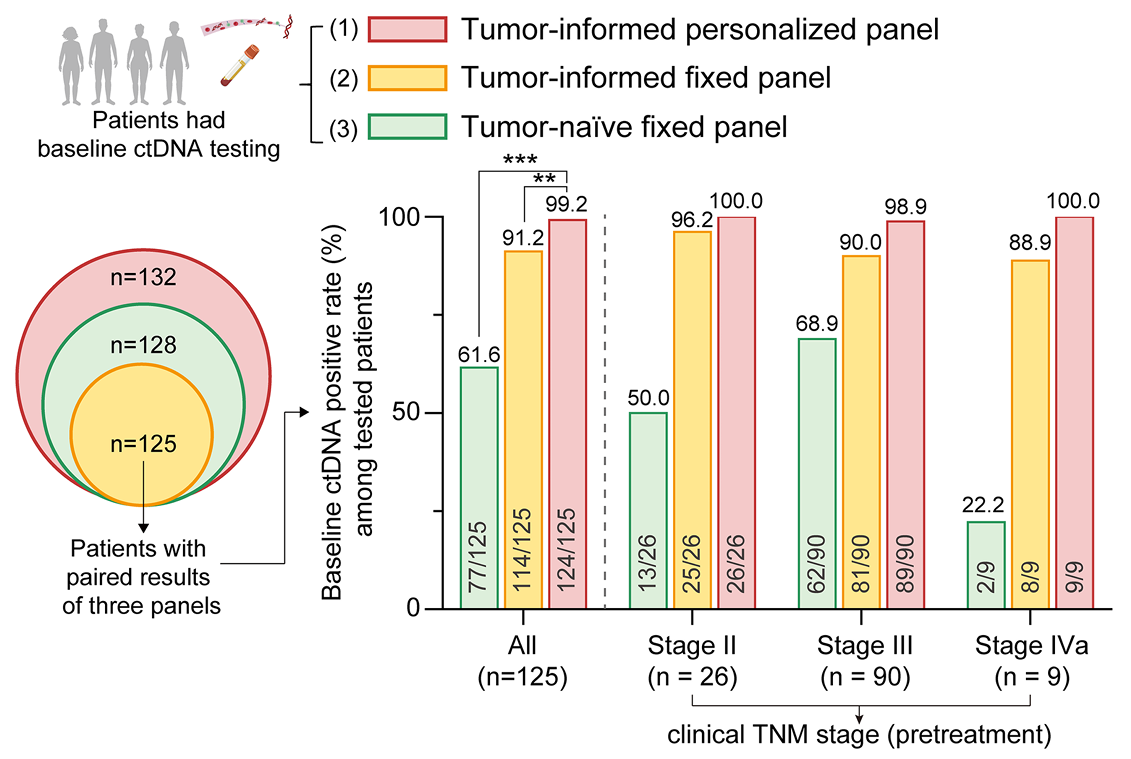
三种ctDNA MRD检测路线的性能比较(基线)
在nCRT后的CRE-1和CRE-2时间点,个性化panel仍保持最高的阳性率(CRE-1: 48.8% vs 20.2% vs 29.5%;CRE-2: 40.6% vs 14.5% vs 20.3%)。值得注意的是,个性化panel可检测到低至0.004%的ctDNA分数,进一步证实其在低肿瘤负荷下的高灵敏度。
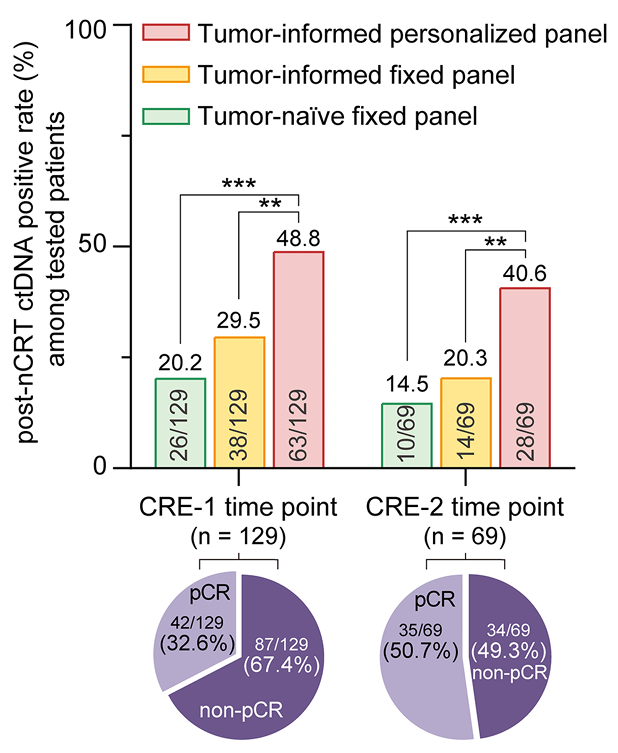
三种ctDNA MRD检测路线的性能比较(nCRT后)
ctDNA联合临床反应评估提升残留病灶检测敏感性
将个性化ctDNA检测与CRE结合后,预测non-pCR的敏感性从78.4%~80.7%显著提升至92.0%~93.2%,假阴性率从传统方法的19.3%~21.6%显著降低至6.8%~8.0%。具体而言,36例CRE-1阴性的non-pCR患者中,13例(36.1%)通过个性化panel检出ctDNA阳性,其中仅7例在 CRE-2中被临床评估识别,提示ctDNA可帮助避免不必要的手术延迟。
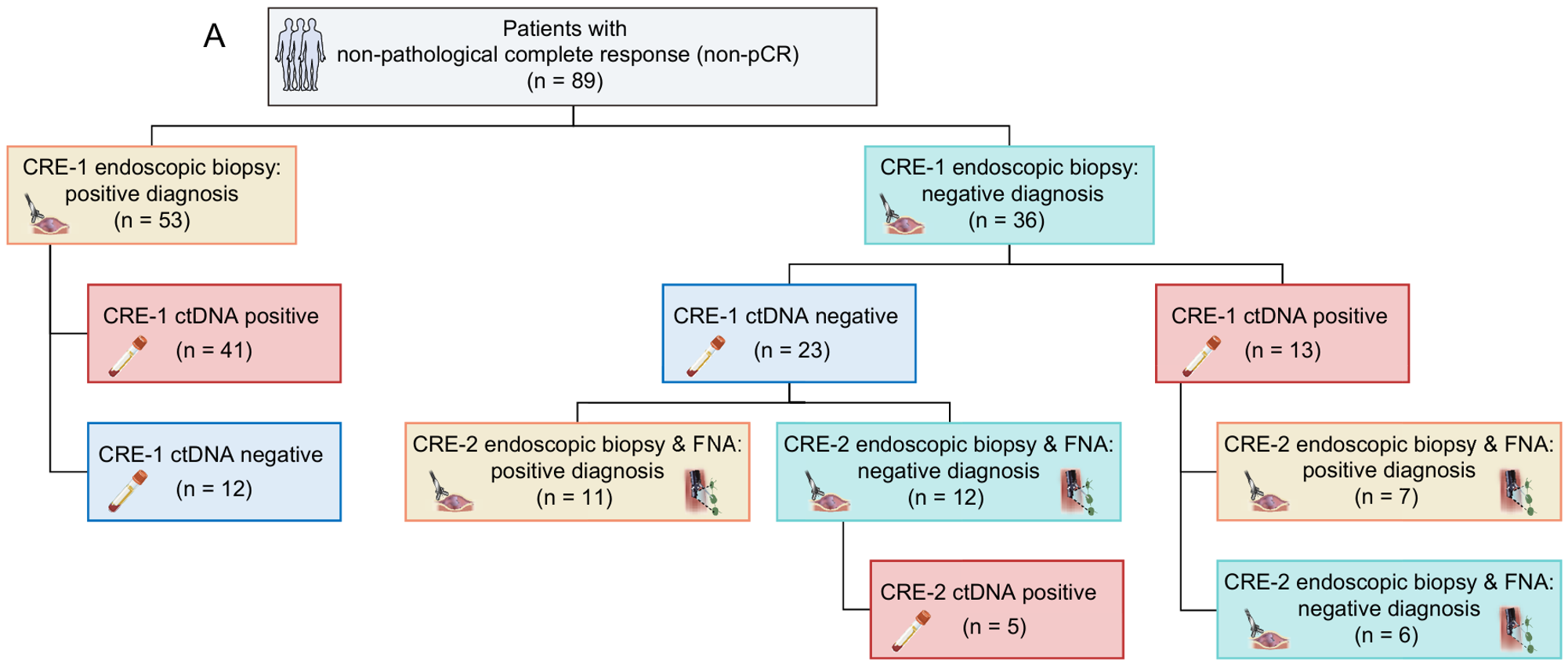
non-pCR患者nCRT后CRE-1/2和ctDNA检测流程图
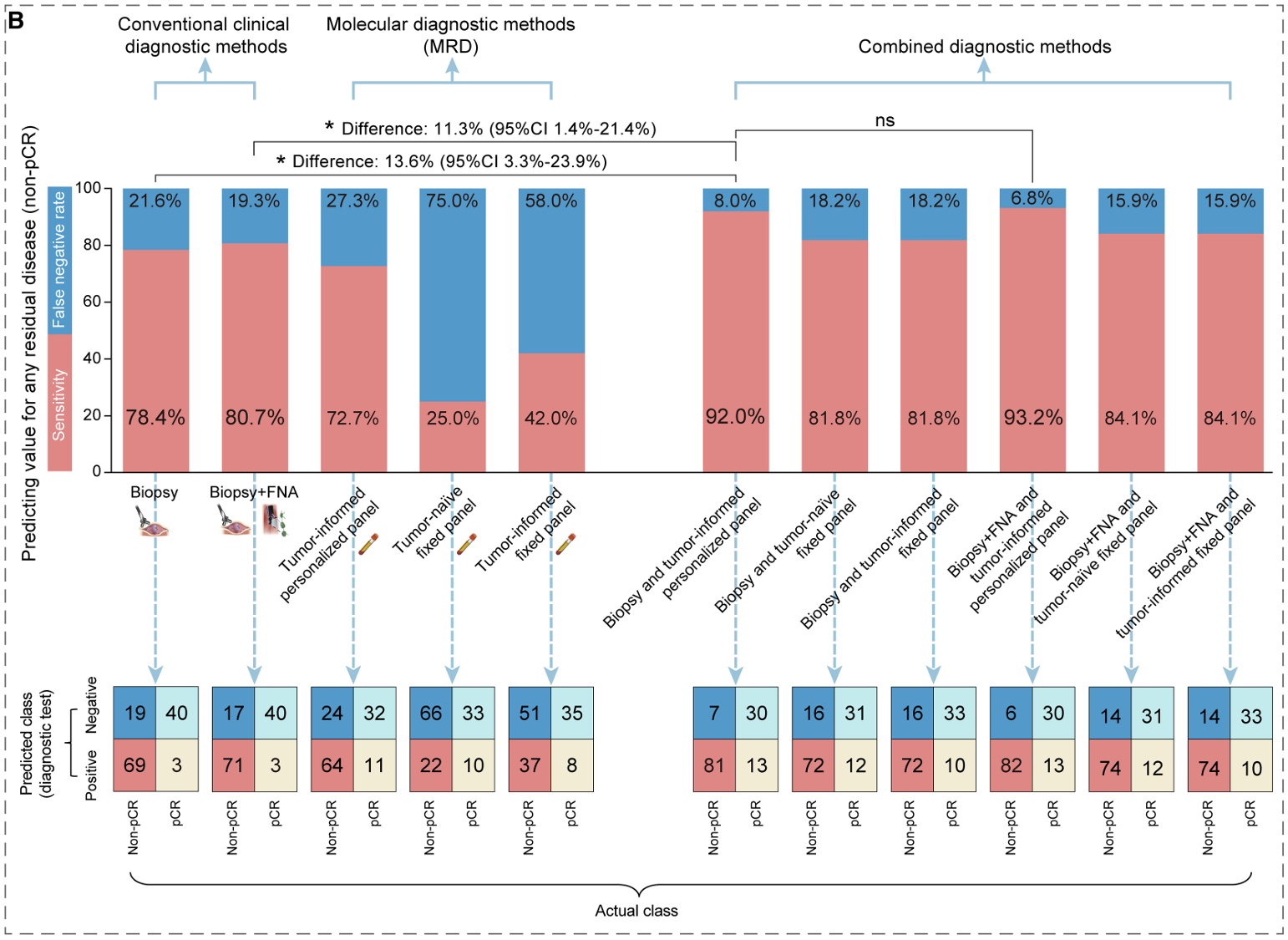
个性化ctDNA联合传统临床评估降低non-pCR的漏诊风险
然而,联合策略也带来了假阳性率的上升。在43例pCR患者中,13例因CRE或ctDNA阳性被误判为非pCR。进一步分析发现,ctDNA阳性(11例)的pCR患者其远处复发率显著更高(36.4% vs 6.3%,P=0.01),提示ctDNA可能检测到了临床方法未能发现的隐匿性系统性疾病。
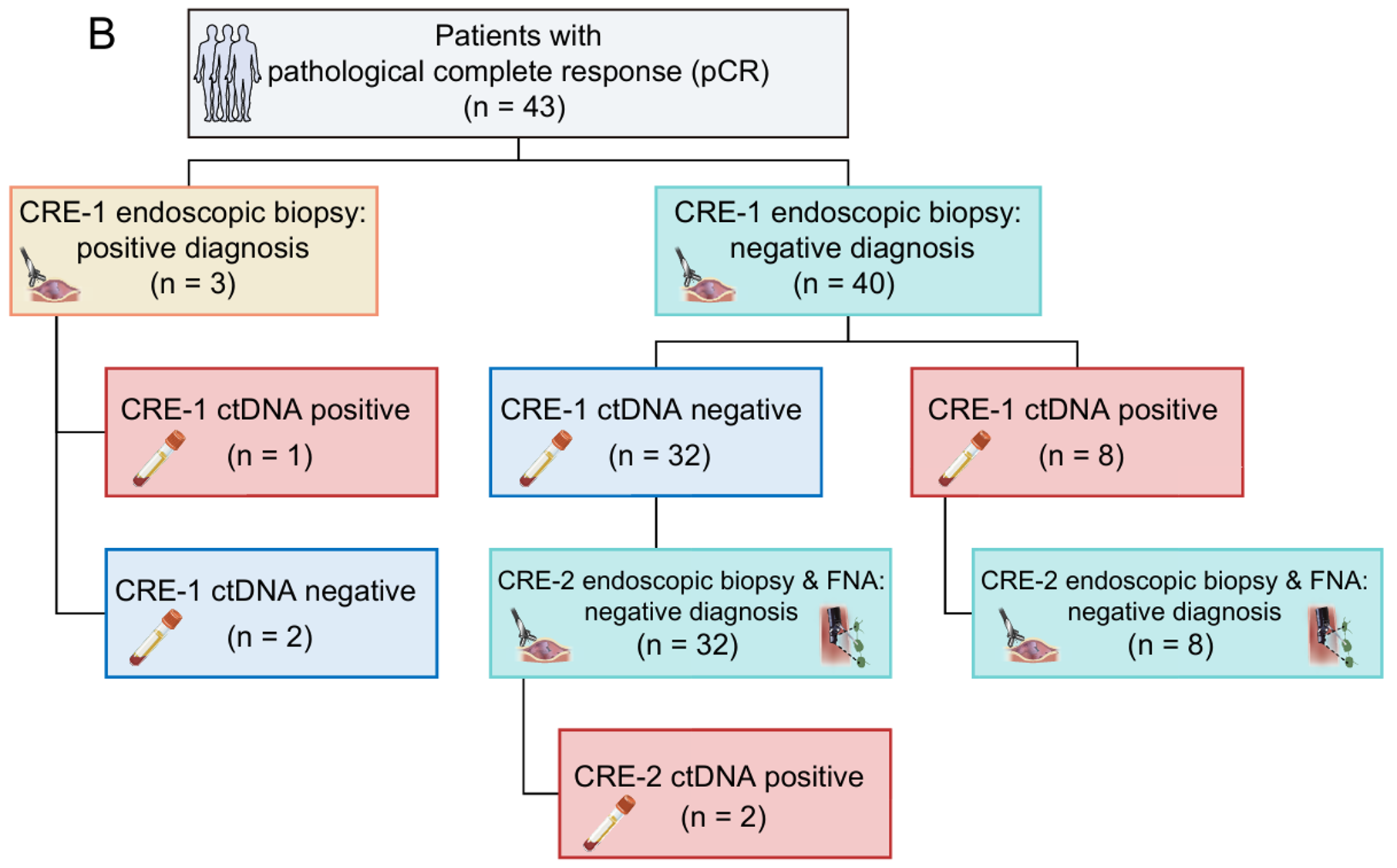
pCR患者nCRT后CRE-1/2和ctDNA检测流程图
术后ctDNA有效预测复发风险,更好地指导辅助治疗决策
术后3–4周(F1时间点)ctDNA阳性与更差的DFS(HR=8.80, 95%CI: 4.28–18.11)和OS(HR=10.03, 95%CI: 3.92–25.65)显著相关。多变量Cox回归分析确认术后ctDNA阳性是独立的预后因素。此外,术后3–6个月(F2时间点)ctDNA阳性及纵向MRD状态(F1或F2任一阳性)均与更高的复发和死亡风险相关。
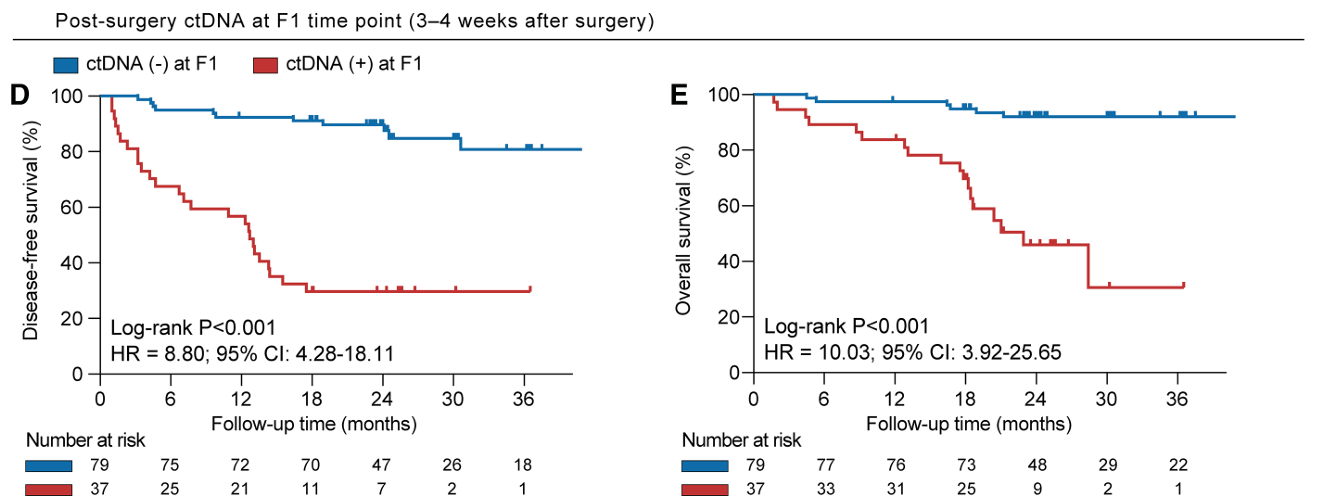
术后3-4周ctDNA与DFS/OS相关性
在术后ctDNA阳性的患者中,non-pCR患者接受辅助免疫治疗后DFS显著改善(HR=0.34, 95%CI: 0.13–0.89),而pCR患者即使未接受辅助治疗其预后也较好。相反,在ctDNA阴性的患者中,无论是否接受辅助免疫治疗,其DFS和OS均无显著差异。多变量分析进一步证实,仅在ctDNA阳性的non-pCR患者中,辅助免疫治疗能带来显著的生存获益(校正后HR=0.24, 95%CI: 0.07–0.80, P=0.021)。
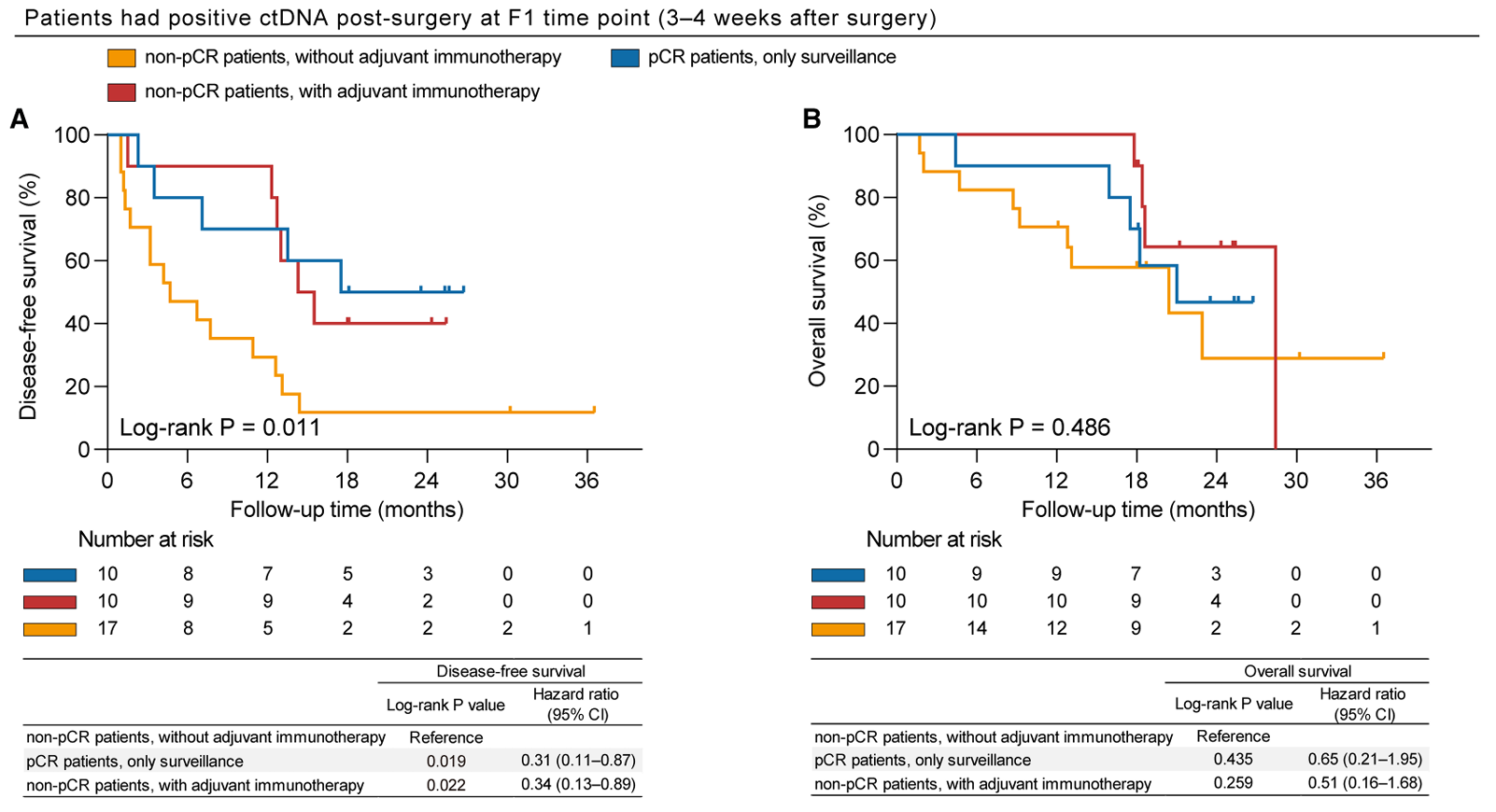
术后3-4周ctDNA阳性的DFS与OS
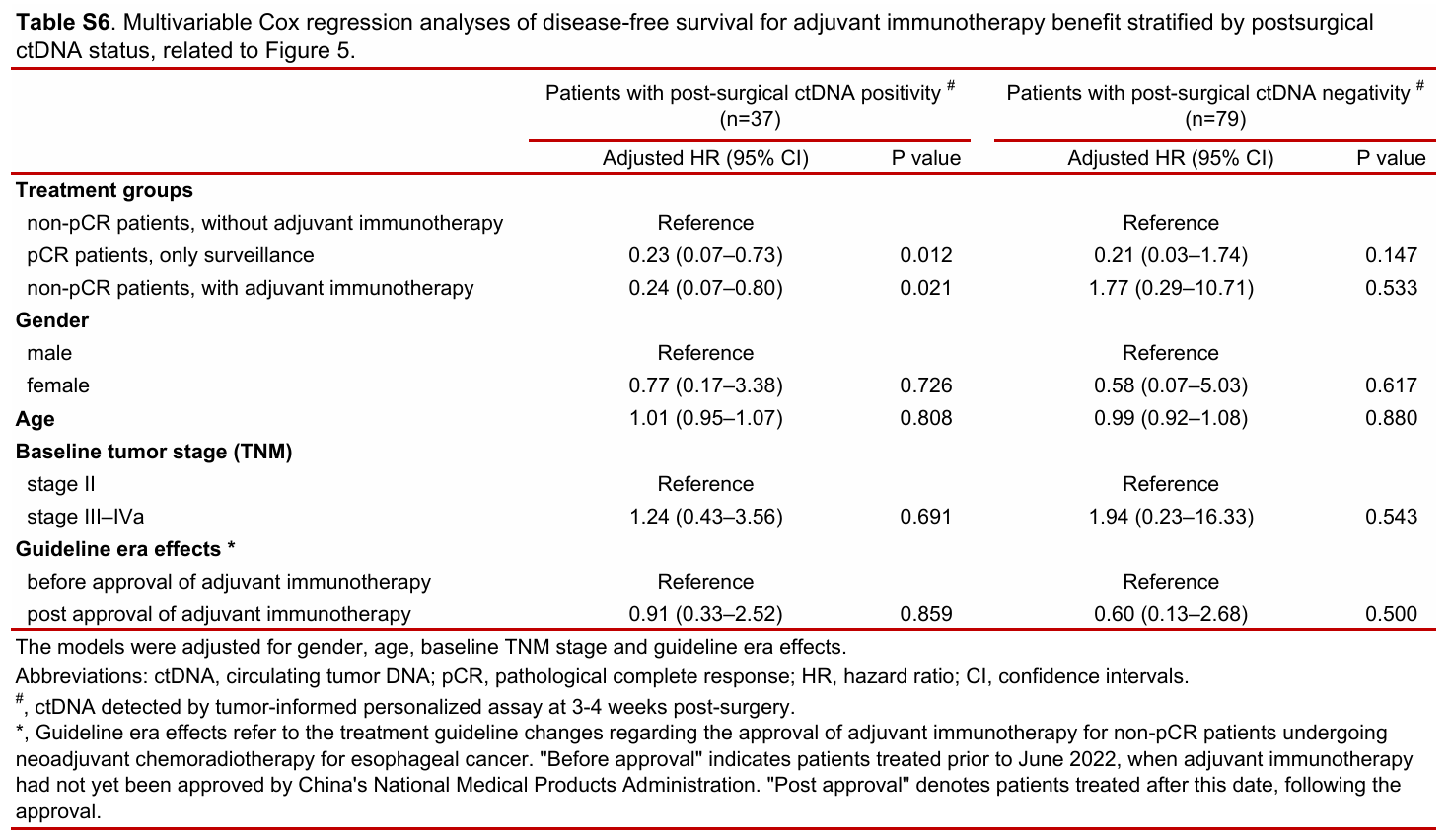
根据术后ctDNA分层行辅助免疫治疗的DFS多因素Cox回归分析
新辅助围术期联合MRD评估指导患者预后分层的适应性治疗管理策略
根据上述结果,该研究创新性地将MRD检测整合至食管癌新辅助围手术期管理,在国际上首次提出了新辅助围术期联合MRD评估指导患者预后分层的适应性治疗管理策略。
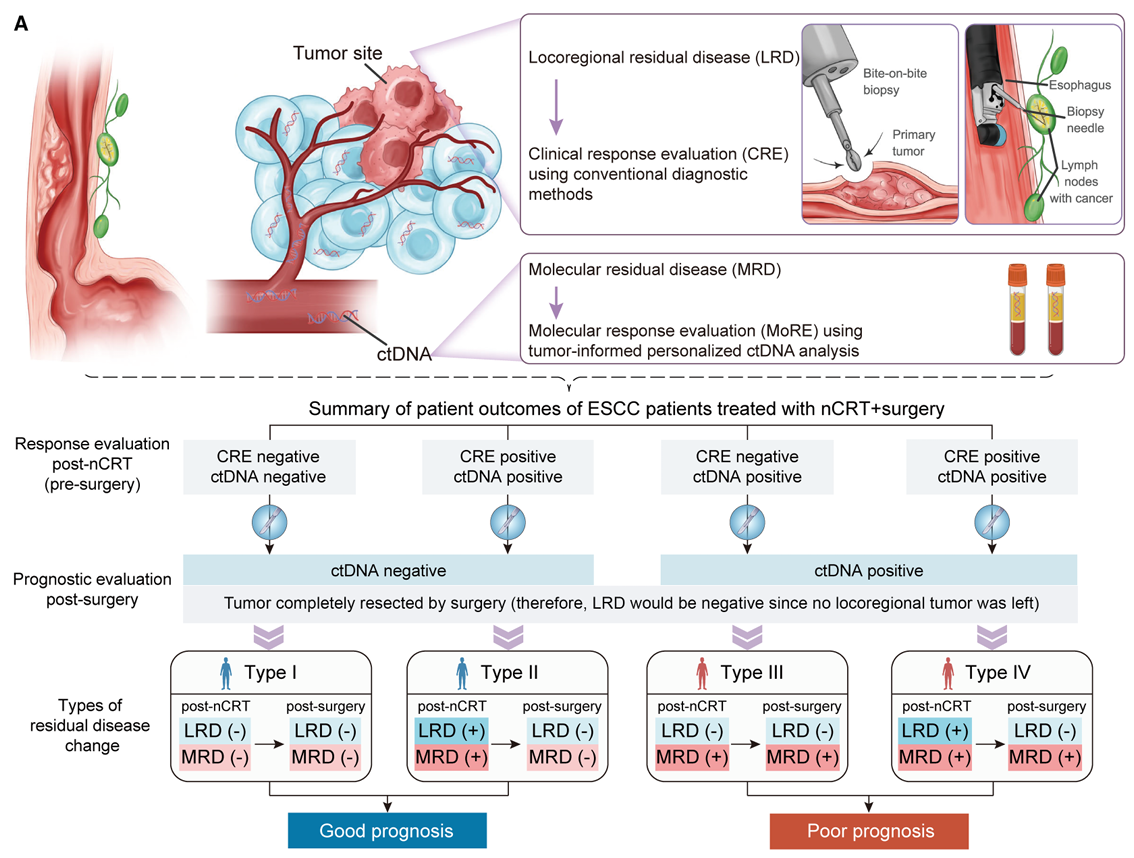
基于MRD和LRD的4种预后
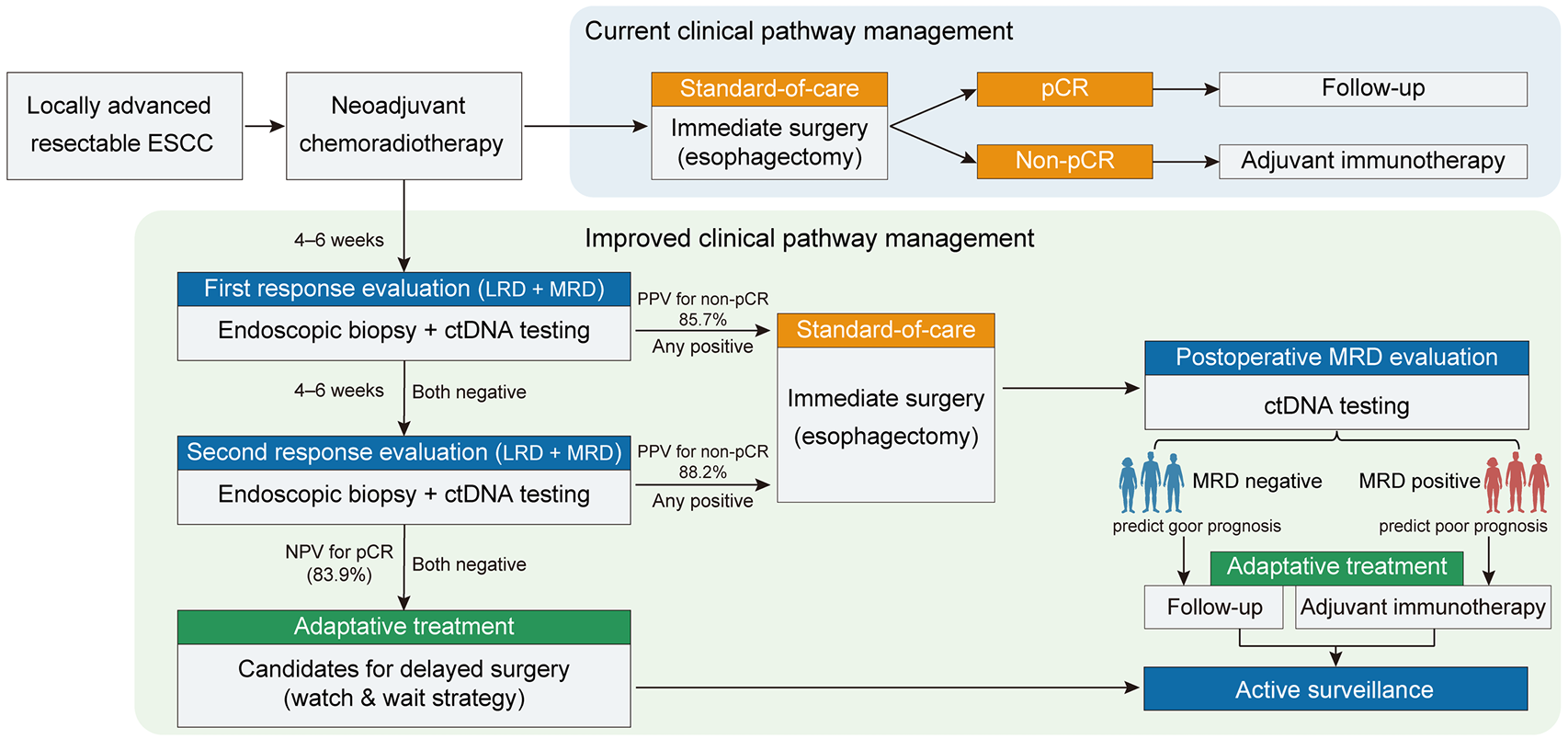
结合ctDNA检测进行疗效评价和术后风险分层的改良临床路径
研究结论
该研究支持将ctDNA纳入ESCC的围术期管理路径,通过分子反应评估(MoRE)与临床评估(CRE)的整合,实现更个体化的治疗决策,最终推动食管癌管理向精准医学迈进。据悉,上海市胸科医院已率先启动了国际首个采用“MRD联合传统临床评估方法”诊断cCR的食管癌保器官治疗前瞻性临床试验 (NCT06861894)。未来,我们期待更多针对新辅助围术期(术前及术后)的适应性治疗相关临床试验的的开展与证据积累,进一步推动这一理念在临床上的广泛应用。
来源:肿瘤界