2025年9月8日,国际肺癌研究协会(IASLC)主办的播客节目“Lung Cancer Considered”第314期内容如期上线。本期节目特别从2025年世界肺癌大会(WCLC)举办地西班牙巴塞罗那现场发来。节目由同济大学附属上海市肺科医院苏春霞教授担任主持,特邀浙江大学医学院附属第二医院夏旸教授与中国医学科学院肿瘤医院毕楠教授作为嘉宾,围绕本年度WCLC的多项重磅研究展开深度对话。三位专家聚焦EGFR突变非小细胞肺癌(NSCLC)靶向联合治疗、局限期小细胞肺癌(LS-SCLC)放疗优化、ctDNA动态监测及肺结节精准诊疗新技术等前沿议题,为临床实践提供最新循证参考。“肿瘤界”特整理访谈精粹,以飨读者。

播客音频
访谈精粹
苏春霞 教授
大家好,本期节目围绕2025 WCLC论坛展开讨论。首先请教夏教授,大会哪个演讲令您印象最为深刻?例如,我个人较为关注的FLAURA2研究(PL02.06)OS结果终于公布。临床中已有TKI单药、联合方案(如FLAURA2、MARIPOSA)用于EGFR突变NSCLC,这些结果是否会改变您的临床实践?
夏旸 教授
FLAURA2研究的OS结果确实振奋人心:中位OS延长近10个月,死亡风险下降23%。这解答了临床多年的疑问:TKI联合化疗能否为患者带来生存获益?
早在一代EGFR-TKI时代,NEJ009研究就试图回答这个问题,但当时争议很大,该研究仅获PFS阳性,OS无显著获益,导致联合化疗未改变临床实践。如今三代TKI时代,FLAURA研究的OS阳性结果确立奥希替尼单药一线地位(2018年中国获批),“如何进一步优化一线策略”成为新焦点,FLAURA2研究正是这一探索的关键结果。我还记得去年WCLC现场,美国丹娜法伯癌症研究院Pasi A. Jänne教授报告FLAURA2的PFS强阳性结果时,我们就格外期待OS数据,如今OS阳性不仅有统计学意义,相信也更具临床价值。但是否所有患者都需联合化疗?如何筛选获益人群?此前我们观察到脑转移患者从联合方案中PFS获益最突出,而今年数据显示各亚组获益均很显著。
此外,中国医学科学院肿瘤医院王洁教授的ACROSS 2研究(PL02.09)补充了“共突变人群”的答案——针对EGFR突变合并TP53、KRAS、PTEN等共突变患者,TKI联合化疗同样延长PFS,虽中位延长幅度不及FLAURA2,但HR值仍提示获益。这启示我们,未来或可聚焦“共突变”制定精准联合策略,但还需更多数据验证。
苏春霞 教授
感谢分享。正如夏教授所言,在标准单药治疗之外,FLAURA2为我们带来一个拥有OS证据的联合治疗选择。但在真实世界中,仍有许多问题需要讨论:适合联合治疗的人群、化疗加入时机、疗效监测方式、耐药机制及后续处理,还有ECOG PS评分差、高龄、合并症多的患者如何选择,这些都需要未来持续探索。无论如何,FLAURA2都是一项里程碑式的研究。
接下来请教毕教授,您在大会报告了一项关于LS-SCLC的多中心III期研究(PL03.07),对比了3周超分割放疗与6周常规分割放疗同步化疗的模式。能否分享这项研究的初衷、结果及其对临床实践的指导意义?
毕楠 教授
SCLC因其难治性在过去30年进展有限。近年来才有突破,如ADRIATIC研究确立了LS-SCLC放化疗后免疫巩固的新标准。而放疗领域,我们也在探索更优方案。
传统LS-SCLC放疗标准是上世纪90年代INT0096研究确立的“3周超分割方案”(每日2次放疗),虽疗效明确,但实施不便,临床应用率不足50%。随着放疗技术(如调强放疗IMRT、容积旋转调强VMAT)和诊断技术(如PET-CT)的进步,让“常规分割下提升剂量”成为可能:如CONVERT研究能安全给到66 Gy,RTOG 0538研究甚至给到70 Gy也很安全,疗效与bid超分割相似。
基于此,我们发起这项多中心III期研究(中国医学科学院肿瘤医院王绿化教授牵头),联合国内16家肿瘤中心/综合医院,纳入530例LS-SCLC患者,对比“3周大分割放疗”与“6周常规分割放疗”联合同步化疗的疗效与安全性。在研究推进过程中,我们还创新改进了食管保护技术以便于患者更好的进行大分割放疗。
结果非常鼓舞人心:两组中位OS均超40个月,不劣于ADRIATIC等国际研究的对照组。两组疗效在数据上相似,但3周方案的优势在于大大节省了患者时间与治疗成本,性价比更高。一个意外的亮点是,3周方案对淋巴细胞的损伤远低于6周方案(≥2级淋巴细胞减少发生率显著更低),这在免疫时代意义重大,未来或可探索“短程放疗+免疫”的联合潜力。
苏春霞 教授
这项研究真正从患者角度出发,用精准技术缩短疗程、降低毒性,非常有价值!
当前NSCLC与SCLC患者治疗选择丰富,但临床亟需无创、精准的生物标志物指导治疗。夏教授,您在大会报告了一项“ctDNA动态监测预测肺癌疗效”的研究(MA03.04)。能否请您详细分享?
夏旸 教授
随着驱动基因阳性晚期NSCLC的治疗选择日益丰富,“化繁为简”(精准筛选获益人群)成为关键,ctDNA检测是实现这一目标的重要工具,但其最佳监测策略仍待进一步优化。
这项研究提出三种ctDNA的监测策略,分析了ctDNA在恩沙替尼治疗METex14跳突晚期NSCLC中的应用:①仅监测MET变异(包括METex14跳突、MET扩增、MET融合等);②监测所有I类与II类突变;③监测泛肿瘤突变。
研究旨在明确:在单纯监测MET变异的基础上,扩展到I/II类或泛突变,能否提高敏感性?反之,增加监测指标是否会引入噪音,导致特异性下降?
结果发现:“多即是少”——仅监测MET变异时,特异性、敏感性、阳性预测值达到最佳平衡;若扩展至I/II类突变或泛突变,敏感性虽略有提升,但特异性显著下降,假阳性增多。因此,这对ctDNA动态监测的优化策略是一个很好的启示。
苏春霞 教授
非常有趣且细致的研究。临床上我们需要能落地、患者可用、快速、简单且性价比高的标志物。这项研究对临床实践有很好的提示作用。
免疫治疗在改善LS-SCLC的预后方面显示出希望,却缺乏疗效预测标志物及预后分层策略。毕教授,您的一项口头报告探讨“ctDNA优化LS-SCLC巩固免疫治疗(MA11.09)”,能否请您详细分享?
毕楠 教授
SCLC的疗效预测标志物比NSCLC更少,因其PD-L1表达低,属“冷肿瘤”。但临床上确实看到约25%的LS-SCLC患者可通过放化疗实现治愈。ADRIATIC研究也显示,部分患者能通过免疫巩固进一步提高疗效、延长生存甚至治愈。有趣的是,度伐利尤单抗巩固治疗主要降低的是胸外远转移风险,而非胸内复发,这与早期NSCLC认知既有相似也有独特之处。
去年WCLC我们报告的研究(2024 WCLC Abstract MA17.05)已表明,放疗后MRD清零患者的预后更好。
本次研究纳入177例接受过标准放化疗(CCRT)的LS-SCLC患者,其中77例在CCRT后接受免疫巩固治疗;通过采集诱导化疗后/放疗前、放疗后和疾病进展时的血浆ctDNA,分析ctDNA变化与疗效的关系。研究发现:
与既往认知相似,放化疗后ctDNA清零者预后较好,但从免疫巩固中获益可能有限;未清零患者则能从免疫巩固中获益更多
早清零(2周期诱导化疗后即清零)的患者预后较好,后续免疫巩固获益有限
而诱导化疗后未清零的患者,即使肿瘤缩小,未来远处转移和复发风险更高,这部分患者接受免疫巩固治疗的意义可能更大
不过目前样本量较小、随访时间较短,需更大样本验证,但这为SCLC免疫治疗的“分层策略”提供了方向,即通过ctDNA动态变化筛选真正需要免疫巩固的患者。
苏春霞 教授
我们中心前一段时间也完成了一项针对广泛期小细胞肺癌(ES-SCLC)的研究。尽管研究设计始于IMpower133和CASPIAN研究结果公布之后,采用的是PD-1抑制剂联合化疗的方案,但是其临床结果与大型III期研究具有可比性。但我们在后续分析中意识到,必须进行充分的生物标志物探索,因此同步开展了基于组织(tissue-based)和血液(blood-based)的转化研究。这项研究的临床数据和基于组织分析的结果近期已在STTT发表(DOI:10.1038/s41392-025-02252-5),而本次我们非常荣幸其ctDNA部分入选WCLC报告(MA11.08)。
在此项分析中,我们收集了患者的基线及动态血浆样本进行ctDNA检测。最终纳入分析的包括42份基线血液样本、37份动态采血样本(脱落率较低)以及16份疾病进展期样本。根据PFS是否超过6个月,将患者分为持久临床获益(Durable Clinical Benefit, DCB)组与非持久获益(Non-Durable Benefit, NDB)组。
我们的发现主要有以下几点:
突变谱:TP53和RB1是主要的突变基因。此外,我们还发现LRP1B、ZFHX4、MUC16、EPHA6和NOTCH1等基因的突变频率超过15%,提示这些基因可能是SCLC发病机制中潜在的替代驱动因素。
最大体细胞等位基因频率(MSAF):NDB组患者的最大体细胞等位基因频率MSAF水平更高。基线MSAF较低的患者PFS和OS均显著改善。单因素和多因素Cox回归分析均证实,基线MSAF是PFS和OS的独立预后因素。
ctDNA动态变化:根据治疗后血液肿瘤异质性降低幅度(ΔbITH)、log10转化单倍体基因组当量/mL变化值(Δlog10hGE)对临床结局分层显示,ΔbITH降幅更大的患者PFS更长(8 vs 6.1个月),Δlog10hGE降幅更大的患者PFS也更优(7.3 vs 5.7个月)。这表明,bITH和log10hGE指标在治疗过程中呈进行性下降,与治疗反应一致。
耐药模式:根据遗传学变化差异,对比基线与进展期样本得出两种耐药模式:获得性耐药(进展期新出现突变)主要富集于RTK通路、染色体重塑、DNA损伤应答、NOTCH通路;原发性耐药(基线与进展期均有突变)主要富集于染色体重塑、表观遗传调控通路。这两种不同的耐药模式,在一定程度上解释了SCLC免疫治疗疗效差异的内在原因。目前,我们已基于上述结果开展队列研究验证,期待尽快成文。

MA11.08摘要图
Longitudinal Circulating Tumor DNA Dynamics Predict Therapeutic Efficacy in ES-SCLC Treated With Immunotherapy
最后,请夏教授分享您报告的另一项关于肺癌诊疗新技术的研究(MA05.09)。这项新技术对早期诊断和治疗有何影响?以及团队后续计划?
夏旸 教授
肺结节的精准诊断是目前临床面临的一大挑战。低剂量螺旋CT的广泛应用虽能高效筛查出肺结节,但其高敏感性伴随的低特异性,导致了显著的过度诊断问题,引发患者不必要的焦虑,甚至导致过多的侵入性检查和非必需的手术。
现有解决方案存在明显局限:对于<1 cm的小结节,ctDNA释放量极低,检测灵敏度不足;甲基化检测虽有一定探索,但单用性能仍不足以支撑临床决策,常需与影像组学等结合使用。
为解决这一难题,我们的研究回归肿瘤发生发展的本源——免疫逃逸机制。恶性肺结节多为极早期的肺癌,识别其源头的免疫功能异常是关键。然而,直接检测结节内部的免疫状态面临技术困难。因此,我们创新性地将目光转向外周血循环免疫系统,假设肺结节引发的系统性免疫反应可以在血液中被捕捉到。
基于该思路,我们采用单细胞质谱流式技术(CyTOF),对外周血免疫细胞进行了超高维度的精准解析。研究使用40种标志物,成功刻画了143个免疫细胞亚群的精细图谱。分析发现,良性结节与恶性结节患者的外周免疫特征存在显著差异。随后我们利用随机森林方法,从海量数据中筛选出10余个最具预测价值的核心免疫特征,并据此构建了全新的SMART检测平台。
SMART平台在包含1032例受试者的多中心队列中进行了验证,人群谱系覆盖全面,从健康无结节者、各类良性结节(含术后确诊和长期随访稳定者)、癌前病变(AAH)、原位癌(AIS),到微浸润癌(MIA)、浸润性癌(IA)乃至晚期患者。验证结果发现SMART给出的恶性评分在这些人群中逐级上升,反映了免疫逃逸程度与肿瘤进展的相关性。这表明,该平台不仅能有效区分结节的良恶性,更有望在术前无创评估结节的浸润程度。
通过这个以临床需求驱动而建立的SMART平台,我们希望能为肺结节的全程管理提供一种新的、高效精准的策略。
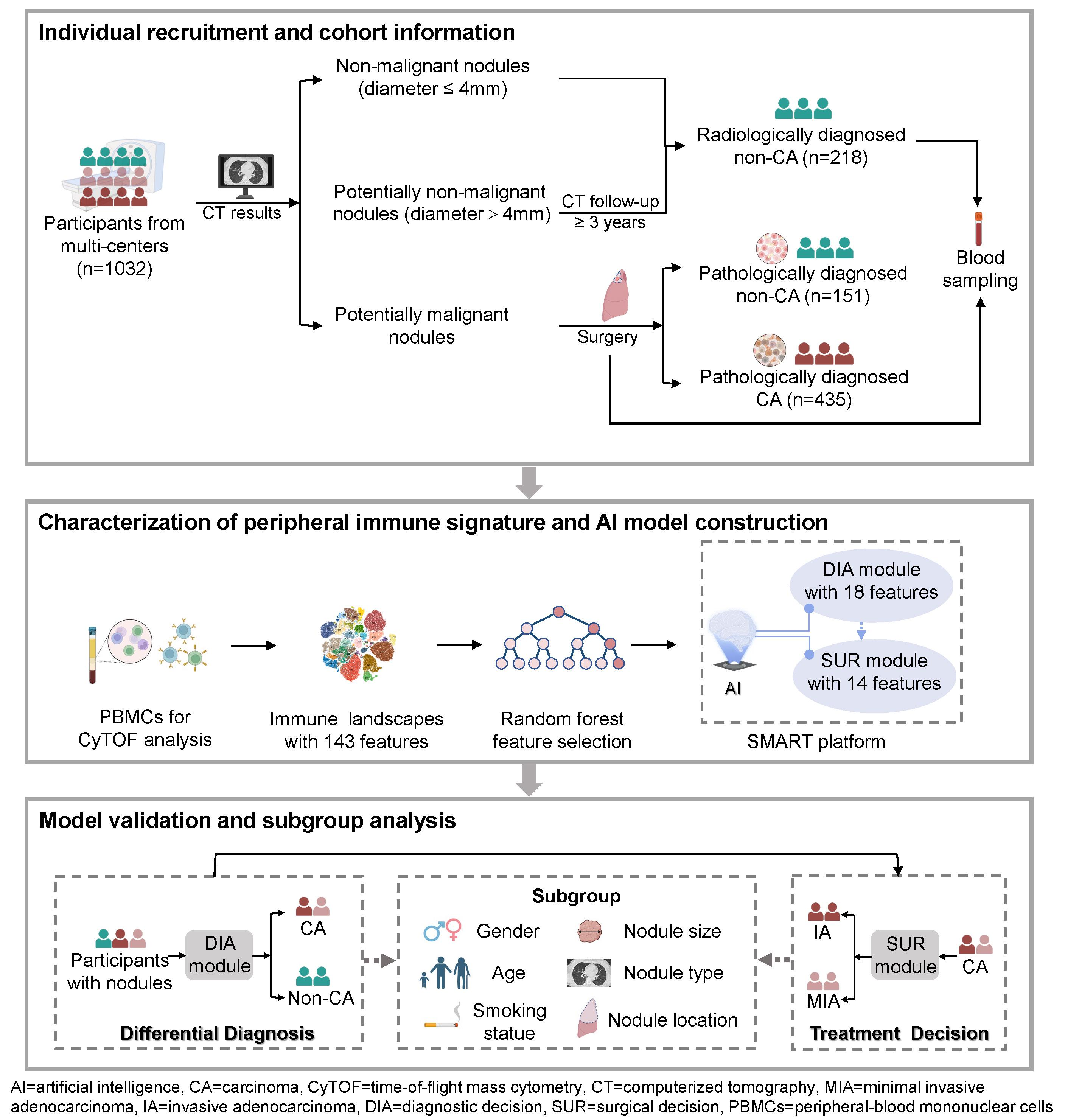
MA05.09摘要图
Precise Diagnosis of Small Malignant Pulmonary Nodules Driven by Peripheral Single-Cell Immune Signatures: A Prospective Multi-Center Study
苏春霞 教授
非常感谢二位教授的精彩分享。今天我们借着2025 IASLC世界肺癌大会的现场契机,展开了一场覆盖面极广的深度讨论:从NSCLC到SCLC,从治疗策略优化到诊断技术创新,基本覆盖了肺癌“防、筛、诊、治、康”全流程链条。我们正处在肺癌诊疗的黄金时代,患者有了更多选择,而我们的目标始终是“让患者活得更长、更好”。
专家简介

苏春霞 教授
教授,主任医师,博士生/博士后导师
同济大学附属上海市肺科医院肿瘤综合诊治中心主任
国家重点研发计划首席科学家
上海市优秀学术带头人/上海市东方英才计划拔尖项目
美中抗癌协会USCACA Co-President联席主席
国际肺癌协作组织多学科协作委员会委员
中华医学会肿瘤学分会青年委员
中国初级卫生保健基金会肿瘤临床转化研究专委会主委
中国抗癌协会肿瘤药物临床研究专委会常委兼秘书长
中国临床肿瘤学会患者教育专委会副主委
中国临床肿瘤学会转化专委会、免疫治疗专委会常委
中国医促会肿瘤免疫治疗学分会常委
上海市抗癌协会青年理事会副理事长
近五年主持国家重点研发计划1项、国家自然科学基金4项、省部级课题10余项,牵头国内多中心研究21项
荣获国家科技进步二等奖、中国抗癌协会科技奖一等奖、上海市科技进步一等奖、上海市“医树奖”一等奖、五洲女子科技奖临床医学科研创新奖等

夏旸 教授
副主任医师,副教授,博士生导师
浙江大学医学院附属第二医院呼吸与危重症医学科 科室副主任
国家优青、全国优秀中青年呼吸医师
中国医师协会呼吸医师分会青委委员
中华医学会呼吸病分会介入呼吸病学组秘书
国际肺癌学会(IASLC)临床科学委员会委员
中国临床肿瘤学会(CSCO)非小细胞肺癌专委会委员
中国临床肿瘤学会(CSCO)青年专家委员会委员
浙江省医学会呼吸病分会委员

毕楠 教授
主任医师,博士研究生导师
中国医学科学院肿瘤医院放疗科副主任,胸组主任
分子肿瘤全国重点实验室PI,美国密歇根大学放疗科访问学者
国家优秀青年医师
中国临床肿瘤学会(CSCO)理事、 小细胞肺癌专委会副主委、非小细胞肺癌专委会常委、放疗专委会委员
中华医学会放疗分会、抗癌协会放疗专委员会青年学组副组长
中国抗癌协会肺癌专委会、肿瘤放疗专委会委员
国家卫健委原发性肺癌规范化诊疗指南(2022版)审定专家、 CSCO《小细胞肺癌指南》执笔专家
获IASLC ‘Developing Nation Award’、国家科技进步二等奖、三项省部级科技进步二等奖、北京优秀医师、国之名医等奖项
第一/通讯作者在Lancet Oncol、J Clin Oncol、Ann Oncol、Mol Cancer(2)、Clin Cancer Res(2)、 Cancer Res、 Int J Radiat Oncol Biol Phys(专业顶刊,3)、Radiother Oncol (专业顶刊,7)等发表论文,成果入选美国放疗学会ASTRO CME课程、C100、ESI高引论文
编辑:lagertha
审核:苏春霞教授