引用本文:中国临床肿瘤学会非小细胞肺癌专家委员会,国家癌症中心肺癌质控专家委员会. EGFR-TKIs耐药后应对策略及标准化质量控制中国专家共识[J]. 中国肿瘤临床与康复,2025,32(9):547-572. DOI:10.13455/j.cnki.cjcor.113494-20250721-0274.

【摘要】 肺癌是我国发病率和死亡率均位居首位的恶性肿瘤,其中非小细胞肺癌(NSCLC)是肺癌的主要病理类型,约占肺癌总数的 80%~85%,包括肺鳞癌、肺腺癌等。表皮生长因子受体(EGFR)突变是NSCLC最常见的驱动因素之一,占亚洲肺腺癌患者的40%~60%。随着精准医学的发展,EGFR酪氨酸激酶抑制剂(EGFR-TKIs)已成为EGFR突变晚期NSCLC患者的标准治疗选择。基于EGFR-TKIs的广泛使用,EGFR-TKIs耐药问题成为临床治疗的主要挑战。针对EGFR-TKIs耐药问题,本专家共识编写组系统检索了2020年1月1日至2025年6月30日PubMed、Scopus、Web of Science、CochraneLibrary、Embase和Medline等数据库中关键词为“Non-small cell lung cancer/NSCLC”“EGFR-TKI”“EGFR mutation”“resistance”等的相关文献及国内外大型学术会议报道共392篇,结合现有循证医学证据,组织专家讨论并制定了EGFR-TKIs耐药后应对策略及标准化质量控制中国专家共识,以期指导临床实践。
【关键词】癌,非小细胞肺;表皮生长因子受体酪氨酸激酶抑制剂;耐药;专家共识
DOI:10.13455/j.cnki.cjcor.113494-2025072-0274
肺癌是我国发病率和死亡率均位居首位的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%~85%,包括肺鳞癌、肺腺癌等。表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变是NSCLC中最常见的驱动基因突变,尤其在亚洲NSCLC人群(30%~50%)、肺腺癌(40%~60%)中多见。EGFR突变主要发生在第18~21号外显子上酪氨酸激酶区域,最常见的经典突变为EGFR外显子19缺失(约占45%)和外显子21中的L858R点突变(约占40%)。随着精准医学的发展,EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)已成为EGFR突变晚期NSCLC患者的标准治疗选择。目前EGFR-TKIs分为第一、二代和第三代,其中约50%~60%的患者在第一、二代EGFR-TKIs一线治疗后出现T790M耐药突变。第三代EGFR-TKIs因具有克服该耐药突变的能力,可作为第一、二代EGFR-TKIs一线治疗进展后的二线治疗,同时也凭借多项Ⅲ期随机对照研究的阳性成果,成为当前EGFR突变肺癌的标准一线治疗。虽然EGFR-TKIs显著提升了EGFR突变晚期NSCLC的无进展生存时间(progression-free survival,PFS)和总生存时间(overall survival,OS),但仍无法避免出现疾病进展。因此,EGFR-TKIs耐药问题成为临床治疗的主要挑战之一。
一、共识制定方法
本共识由中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)非小细胞肺癌专家委员会、国家癌症中心肺癌质控专家委员会组织多学科专家结合目前EGFR-TKIs耐药相关临床试验研究及临床实践,围绕EGFR-TKIs治疗耐药后辅助判断、耐药机制及免疫微环境变化、治疗策略、随访,以及标准化质量控制等方面进行讨论,并最终形成,旨在为临床医生提供实用的耐药后应对策略,以进一步延长晚期EGFR突变NSCLC患者的OS并提高患者生活质量。
本专家共识编写组以“Non-small cell lung cancer/NSCLC” “EGFR-TKI” “EGFR mutation” “resistance” “disease progression” “molecular targeted therapy”等为关键词,在PubMed、Scopus、Web of Science、Cochrane Library、Embase和Medline等数据库中进行系统检索,检索时限为2020年1月1日至2025年6月30日,并根据部分文献的参考文献,进行补充检索,纳入相关随机对照研究、荟萃分析、指南共识及国内外大型学术会议报道共392篇。
本共识内容由专家组成员依据现有医学证据及实践经验共同讨论形成。共识证据级别和推荐等级遵循美国公共健康服务美国传染病学会分级系统(经美国传染病学会许可)。证据级别及推荐等级分类见表1、2。
本共识于2025年1月在国际实践指南注册与透明化平台完成注册,注册网址:https://www.guidelines-registry.cn/,注册号:PREPARE-2025CN038。

、EGFR-TKIs治疗耐药的辅助判断及免疫微环境特征
1.影像学检查
EGFR-TKIs治疗期间,建议规律随访,常用检查手段为胸部计算机断层显像(computer tomography,CT)。胸部CT可有效检出早期周围型肺癌、明确病变所在的部位和累及范围,是目前肺癌诊断、分期、疗效评价和随诊的主要影像学检查手段。对于腹部转移病灶,可行腹部增强CT、超声等检查。当患者出现症状恶化或新发症状时建议及时进行影像学检查评估。推荐使用增强磁共振成像(magnetic resonance imaging,MRI)检查判定有无脑转移、局部可疑骨转移及可疑脊髓转移,如果不能进行脑部增强MRI检查,可选择脑部增强CT。骨扫描是判断肺癌患者有无骨转移的常规检查,是筛查骨转移的首选方式,当骨扫描检查发现可疑骨转移时,可行局部MRI、正电子发射计算机断层显像(positron emissioncomputed tomography,PET)-CT等进一步评估转移病灶,以明确诊断。
服用EGFR-TKIs期间,对于无临床症状或症状稳定患者,建议常规颈胸腹部(包括肾上腺)增强或平扫CT(颈部淋巴结及腹部检查可考虑超声)复查,每2~3个月1次,可根据治疗阶段及临床表现调整随访间隔。临床实践中,对于无脑转移的患者,通常颅脑MRI半年1次。对于无症状脑转移的患者,颅脑MRI每2~3个月1次;对于有症状脑转移患者,根据临床表现进行不定期监测。对于无骨转移的患者,可通过常规CT或MRI,以及明确的骨相关事件进行随访;当症状恶化或疾病进展时可以考虑骨扫描。针对脑转移、骨转移患者的监测,目前指南中暂无明确推荐,Ⅲ期临床研究通常采用颅脑MRI每6~12周1次,骨扫描每3~4个月1次的方案,或者根据症状变化灵活调整随访。上述随访方案还需结合个体化评估实施。
2.血清学肿瘤标志物
当前,肿瘤标志物被广泛推荐使用于原发性肺癌的诊断,主要包括癌胚抗原(carcinoma embryonic antigen,CEA)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、细胞角蛋白19片段抗原(cytokeratin 19 fragment antigen 21-1,CYFRA21-1)、胃泌素释放肽前体(pro-gastrin-releasing peptide,ProGRP)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCCA)等。CEA、SCCA和CYFRA21-1的浓度上升,对于NSCLC的诊断具有重要意义。肿瘤标志物联合检测可提高其在临床应用中的灵敏度和特异度。此外,SCCA在肺鳞状细胞癌的诊断中显示出较高的特异性,有助于辅助组织学诊断。NSE和ProGRP作为诊断小细胞肺癌(small cell lung cancer,SCLC)的首选指标,也可用于辅助评估NSCLC是否转变为SCLC。
3.分子病理学检测
对于EGFR-TKIs耐药患者,建议二次组织活检并进行耐药基因检测。常用的分子诊断检测技术包括但不限于免疫组织化学(immunohistochemistry,IHC)、荧光原位杂交(fluorescence in situ hybridization,FISH)、逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)、微滴式数字PCR(droplet digital polymerase chain reaction,ddPCR)、Sanger测序和下一代高通量测序(next-generation sequencing,NGS)技术等。
(1)EGFR T790M检测:对于第一、二代EGFR-TKIs耐药后无法获取组织的患者,可从外周血或胸、腹腔积液中提取循环肿瘤DNA(circulating tumor DNA,ctDNA)进行EGFR T790M检测。当ctDNA阴性时,仍应建议患者行组织检测以明确EGFR T790M突变状态。
(2)EGFR、间质上皮细胞转化因子(mesenchymal-epithelial transition factor,MET)等多基因检测:经济成本可接受的情况下,建议对EGFR-TKIs耐药后的患者进行多基因检测。NGS或RT-PCR多基因联合检测可同时对多个靶点基因的突变、扩增和重排进行检测,NGS测序尤其在鉴别EGFR C797S/T790M顺式及反式突变构象等方面更具优势。T790M/C797S顺式突变为2个基因突变位于同一条DNA链上,而T790M/C797S反式突变为2个基因突变位于不同的DNA链上。可以使用1种或多种方法联合进行广谱分子检测,包括但不限于间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排、c-ros肉瘤致癌因子-受体酪氨酸激酶(ROS proto-oncogene 1, receptor tyrosine kinase,ROS1)融合、转染重排基因(rearranged during transfection,RET)重排、鼠类肉瘤病毒癌基因同源物B1(v-raf murine sar-coma viral oncogene homolog B1,BRAF)基因突变、Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)突变、神经营养因子受体酪氨酸激酶1/2/3(neurotrophic receptor tyrosine kinase 1/2/3,NTRK1/2/3)基因融合、磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基α(phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha,PIK3CA)突变、MET扩增或过表达、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)突变或扩增等,以识别耐药机制。FISH是MET扩增检测的金标准,但当前MET扩增检测存在两大挑战:①缺乏统一临界值,有专家共识推荐判断标准为MET拷贝数≥5或MET/CEP7≥2,而塞普替尼获批的SACHI Ⅲ期研究设定了差异化阈值,对于第一、二代EGFR-TKIs一线治疗耐药后MET扩增定义为MET拷贝数≥5或MET/CEP7≥2,对于第三代EGFR-TKIs一线治疗耐药后MET扩增定义为MET拷贝数≥10;②NGS检测虽与FISH有较好的一致性,但由于不同实验室可能使用不同的NGS平台和生物信息学分析策略,MET扩增的临界值不同,检测结果的呈现方式也可能有所不同。
在EGFR-TKIs治疗过程中,动态监测ctDNA变化可早于影像学及血清学肿瘤标志物识别EGFR突变,绘制肿瘤的基因组图谱,并提供有关耐药突变出现的实时动态信息,有助于临床及时调整治疗方案。
4.EGFR阳性NSCLC免疫微环境特征
EGFR阳性NSCLC具有特定的免疫微环境(tumor microenvironment,TME)特征,这些特征与肿瘤的免疫逃逸机制、疾病进展和治疗反应密切相关。伴有EGFR突变的晚期NSCLC患者表现出明显的免疫抑制特征,通常表现为低水平的CD8+肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TIL),并伴随调节性T细胞(regulatory T cells,Treg)浸润和骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)的增加,这些免疫细胞的积聚在一定程度上抑制了抗肿瘤免疫反应。EGFR突变产生大量负性免疫调节剂如转化生长因子-β(transforming growth factor-β,TGF-β)、白细胞介素10(interleukin 10,IL-10)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和腺苷等,可直接抑制自然杀伤(natural killer,NK)细胞功能、树突状细胞(dendritic cell,DC)成熟和细胞毒性T细胞的功能与增殖。EGFR阳性NSCLC的TME对免疫治疗的反应较为有限,单独使用免疫检查点抑制剂的疗效通常较差。
EGFR-TKIs耐药后TME会出现免疫抑制性改变。一项回顾性研究分析了138 例EGFR非T790M突变、EGFR-TKIs 耐药NSCLC患者的肿瘤微环境,发现 FOXP3+ Treg细胞减少,程序性死亡配体-1(programmed death-ligand 1,PD-L1)表达升高,CD8+肿瘤浸润淋巴细胞密度升高。另有相关研究分别纳入327例一线接受奥希替尼治疗的患者和63例后线接受奥希替尼治疗的患者,对比分析了奥希替尼治疗前、后肿瘤进展阶段的样本,分析结果表明,在奥希替尼治疗后,肿瘤细胞中PD-L1的表达水平上调,并且肿瘤突变负荷(tumor mutational burden,TMB)水平显著上调。一项关于比较联合免疫治疗与标准化疗作为EGFR-TKIs耐药后二线治疗的临床效果的研究分析表明,EGFR-TKIs治疗阶段PFS较长患者的CD3+淋巴细胞、CD8+效应T细胞和干扰素-γ(interferon-γ, IFN-γ)+CD8+ T细胞在TME中浸润的比例明显更高,M2样巨噬细胞比例较低。
共识推荐1:患者服用EGFR-TKIs期间,建议定期做常规复查,进行颈胸腹部(包括肾上腺)增强或平扫CT(颈部淋巴结及腹部检查可考虑超声),如有症状恶化随时复查。随访频率可根据治疗阶段和临床情况调整。目前随访方案主要基于临床经验,未来需更多循证依据优化。(证据级别:V类;推荐级别:强推荐)
共识推荐2:对于EGFR-TKIs耐药的患者,推荐二次活检和基因检测。若组织标本不可及,可考虑液体活检。根据基因检测结果,识别耐药机制,及时调整方案。(证据级别:Ⅰ类;推荐级别:强推荐)
三、进展模式的判定
1.非广泛进展定义
目前NSCLC进展模式分类尚未统一,主要存在2种分类模式:三分类模式(包括爆发进展、缓慢进展和局部进展,或表述为缓慢进展、非CNS局部或寡进展、CNS进展)和二分类模式(寡进展和广泛进展)。本共识采用广义分类法,将寡进展和局部进展统一归为非广泛进展。目前寡进展定义虽未标准化,但专家共识建议将其界定为EGFR-TKIs治疗后出现不超过3个受累器官且病灶总数≤5个的进展状态。评估进展模式时,多个国际组织包括欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)、美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN),欧洲癌症研究与治疗组织(European Organization for Research on Treatment of Cancer ,EORTC),均建议优先进行全身18F-FDG PET-CT扫描,若条件受限,至少进行胸部和上腹部(包括肝脏、肾脏和肾上腺)增强CT检查。对于出现神经系统症状的患者,建议进行脑部MRI。对于特定转移后症状,可选择骨扫描、全身MRI或PET-MRI。值得注意的是,转移状态需通过至少1个病灶的组织活检予以确认,其他相关病灶可在生物学合理性基础上推定其为同源性转移。
EGFR-TKIs 耐药发生寡进展后,采用联合局部治疗策略可显著改善临床疗效。CSCO指南推荐对于寡进展患者应继续原EGFR-TKIs治疗联合局部治疗。一项26例奥希替尼治疗后寡进展患者的回顾性研究显示,接受立体定向放疗(stereotactic body radiation therapy,SBRT)巩固治疗组中位PFS显著优于未接受组(分别为17.2和11.3个月,P=0.002)。对于发生脑转移的患者,需结合肿瘤大小、肿瘤部位、治疗病史和放疗技术能力等多种因素综合评估选择手术或放疗。对于颅外病灶稳定且没有再次基因检测的颅内进展患者,目前仅有小样本研究尝试局部治疗联合第三代EGFR-TKIs加量治疗。随访过程中可结合影像学变化、临床症状变化、血清学肿瘤标志物变化,以及分子病理学检测结果等指标,综合判断疾病是否进展,并及时转变治疗方案进行系统治疗。
2.广泛进展定义
根据EGFR-TKIs治疗后的疾病进展情况,广泛进展指初始治疗无应答后全身或多部位病灶显著进展。对于EGFR-TKIs治疗耐药后出现广泛进展的患者建议更换系统性治疗方案。针对存在不同耐药机制的患者,可参考现有的临床数据,给予双靶联合治疗、靶向联合化疗、抗血管药物等联合治疗策略,或换用其他类型EGFR-TKIs、免疫治疗、新型抗肿瘤药物等。
共识推荐3:EGFR-TKIs治疗后的进展模式可分为非广泛进展(寡进展或局部进展)和广泛进展,对于不同进展模式需要采取不同的应对策略。针对寡进展,可考虑继续原EGFR-TKIs治疗联合局部治疗。针对广泛进展,需调整治疗方案,推荐结合不同耐药机制,选择相应的治疗策略。(证据级别:Ⅰ类;推荐等级:强推荐)
四、耐药机制
EGFR-TKIs主要通过与EGFR酪氨酸激酶区域的三磷酸腺苷竞争性结合,从而阻断EGFR信号通路的传递。当患者经EGFR-TKIs治疗前后发生EGFR基因其他位点的二次突变或EGFR旁路激活等情况时,均可导致对EGFR-TKIs治疗耐药。
1.原发性耐药
原发性耐药是指肿瘤基于生物学或遗传特性而对初始治疗无响应,或接受EGFR-TKIs治疗3个月内疾病进展。大约30%的EGFR突变患者表现出对EGFR-TKIs的原发性耐药。FLAURA研究发现原发性耐药患者在基线时存在特定分子特征,如同时存在 TP53 错义突变,或 RBM10、HER2、MET、SMARCA4、RICTOR 基因异常,以及 PIK3CA共突变、PTEN、RB1、CCND1/2、CCNE1、CDK4/6、BIM缺失多态性等。二代测序能够发现患者基线是否存在上述相关基因共突变,从而有助于判断肿瘤初始的分子学特征。
2.继发性耐药
继发性耐药是指肿瘤初始对治疗药物敏感,或经初始治疗后患者获得缓解或持续临床获益超过3个月,但在后续继续治疗过程中出现的疾病进展。EGFR-TKIs的继发性耐药机制通常可分为EGFR通路依赖性和非依赖性。
(1)EGFR依赖性耐药:常见EGFR依赖性耐药机制主要与干扰EGFR-TKIs共价结合的位点突变有关。EGFR基因20号外显子的T790M位点突变是第一、二代 EGFR-TKIs的主要耐药机制。第三代 EGFR-TKIs药物如奥希替尼虽可同时靶向T790M 耐药突变和EGFR敏感突变,但C797S、L792X、G796S、L718Q 等位点突变均可阻碍奥希替尼与靶点结合,导致奥希替尼EGFR依赖性耐药。
(2)EGFR非依赖性耐药:EGFR非依赖性耐药主要包括旁路激活途径、下游信号通路的激活,以及组织学转化等。①旁路激活途径,包括MET扩增或过表达、HER2突变或扩增、RET融合、ALK融合、NTRK融合、FGFR3融合、ROS1融合等。其中MET扩增较为常见,占全部耐药患者的16%。FLAURA 研究中HER2扩增占2%,RET 融合、ALK 融合等机制发生率为 1%~3%。其他旁路活化耐药机制还包括细胞周期基因异常,如CDK6 扩增、CDK4扩增、CCND1扩增等,发生率约为10%。②下游信号通路的激活,如KRAS、BRAF突变,PIK3CA突变或扩增和细胞周期相关基因异常等。多项研究报道 KRAS G12A、G12C、G12D 突变可介导耐药,见于 2%~7%的耐药患者;BRAF突变和重排也是可能的耐药机制,最常见的是BRAF V600E突变,发生率为 2%~4%。PIK3CA是PI3K通路下游催化亚单位,突变见于3%~7%的奥希替尼一线治疗耐药患者和4%~10%的二线治疗耐药患者,其中E545K突变是最常见突变位点,此外还有E453K突变等。③组织学转化或表型改变,如肿瘤发生SCLC转化、鳞癌转化或上皮间质转化。组织学转化在第三代TKIs一线应用时较后线应用更为常见,发生率约为3%~15%。SCLC转化是最常见类型,此时组织活检是金标准,而进展时液体活检发现RB1和TP53突变也提示神经内分泌转化可能;此外,还有鳞状细胞癌和大细胞神经内分泌癌等转化报道。
需要注意的是,FLAURA研究耐药患者中39%具有多重耐药机制,包括MET/CCND1,MET/BRAF V600E,ALK/EGFR C797S,EGFR/CCNE1/CCND3/HER2等。此外,还有一些无法通过测序检测出的变异,这部分患者耐药机制未知。
近年来,EGFR-TKIs联合化疗方案在临床应用中取得重要突破。基于FLAURA2研究的阳性结果,奥希替尼联合化疗已获批一线治疗适应证,同时,AENEAS2研究也证实了阿美替尼联合化疗的疗效,这提示EGFR-TKIs联合化疗也将成为EGFR突变阳性NSCLC临床实践的治疗选择。FLAURA2研究的耐药机制分析结果显示,奥希替尼联合化疗组与奥希替尼单药组最常见的获得性耐药突变谱类似:C797S突变(分别为3%和12%,单药组更显著)和MET扩增(分别为12%和11%),未检测到新的耐药机制。联合方案耐药机制没有受化疗的影响,和TKIs单药耐药类似。鉴于目前联合化疗方案耐药后的循证医学证据有限,临床实践中可参考TKIs耐药后治疗策略。后线治疗中若再次采用联合化疗方案,建议更换化疗药物种类以避免交叉耐药。
五、耐药后治疗策略
1.克服EGFR依赖性耐药治疗策略
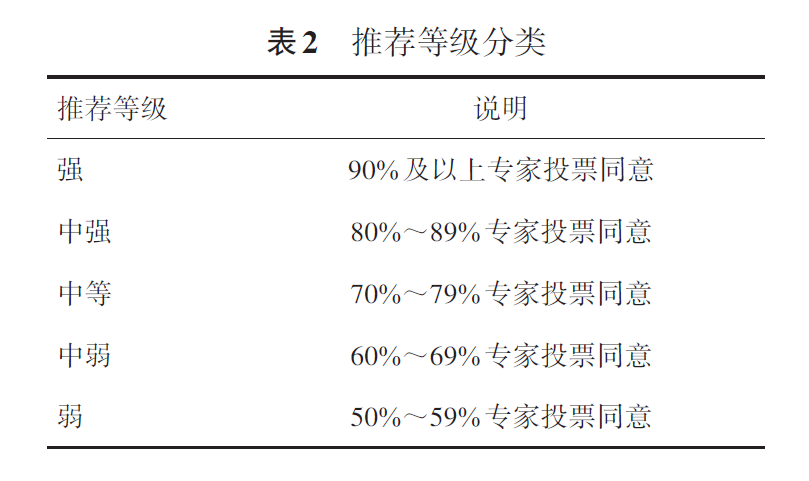
T790M是第一、二代EGFR-TKIs的常见耐药突变,出现T790M突变可换用第三代EGFR-TKIs药物,如奥希替尼、阿美替尼、伏美替尼、贝福替尼、利厄替尼等进行治疗,中位PFS持续时间为10.1~13.7个月,且利厄替尼80 mg每日2次剂量下,中位OS最长达到42.5个月(表3)。C797S突变是第三代EGFR-TKIs最常见的4个EGFR依赖性耐药突变之一,对于经第三代EGFR-TKIs一线治疗仅出现C797S突变的患者,病例报道显示,患者在奥希替尼耐药后,液体活检发现获得性EGFR C797S突变,在接受了第一代或第二代EGFR-TKIs(厄洛替尼或阿法替尼)治疗后均获得了一定程度的缓解,并且能持续一定的有效时间;有临床病例显示,对于第三代EGFR-TKIs二线治疗耐药后出T790M/C797S反式突变的患者,经厄洛替尼和奥希替尼治疗达到部分缓解,然而疾病进展发生在无进展生存3个月后;对于出现EGFR敏感突变/T790M/C797S顺式突变,一项回顾性研究显示,布格替尼联合西妥昔单抗治疗奥希替尼耐药后出现的T790M/C797S顺式突变患者的客观缓解率达60%。一项多队列Ⅰ期研究(CHRYSALIS)结果显示,20例第三代EGFR-TKIs经治伴C797S突变的晚期NSCLC患者,接受埃万妥单抗单药治疗后ORR达到40%(8/20)。第四代EGFR-TKIs尚在早期临床探索中,如BLU-945是一种对C797x突变变异具有选择性的第四代EGFR-TKIs,2023年ASCO报道,BLU-045作为单药或与奥希替尼联用的首次人体试验临床Ⅰ~Ⅱ期试验成果,研究纳入的33例EGFR突变NSCLC患者中,BLU-945治疗后10例患者达到部分缓解。EAI045是在研的第四代EGFR-TKIs之一,EAI045可抑制EGFR的“激活器”亚基,单体形式的EGFR分子对其敏感,体内体外实验证实,EAI045+西妥昔单抗的组合在L858R/T790M±C797S Ba/F3肺癌细胞系和L858R/T790M±C797S基因工程小鼠模型中均显示出理想的抑瘤效果,EAI045联合西妥昔单抗可能成为L858R/T790M双重突变或L858R/T790M/C797S三重突变的肺癌患者的治疗策略之一。但目前各类第四代EGFR-TKIs尚缺乏成熟有效的临床研究数据。
2.克服EGFR非依赖性耐药治疗策略
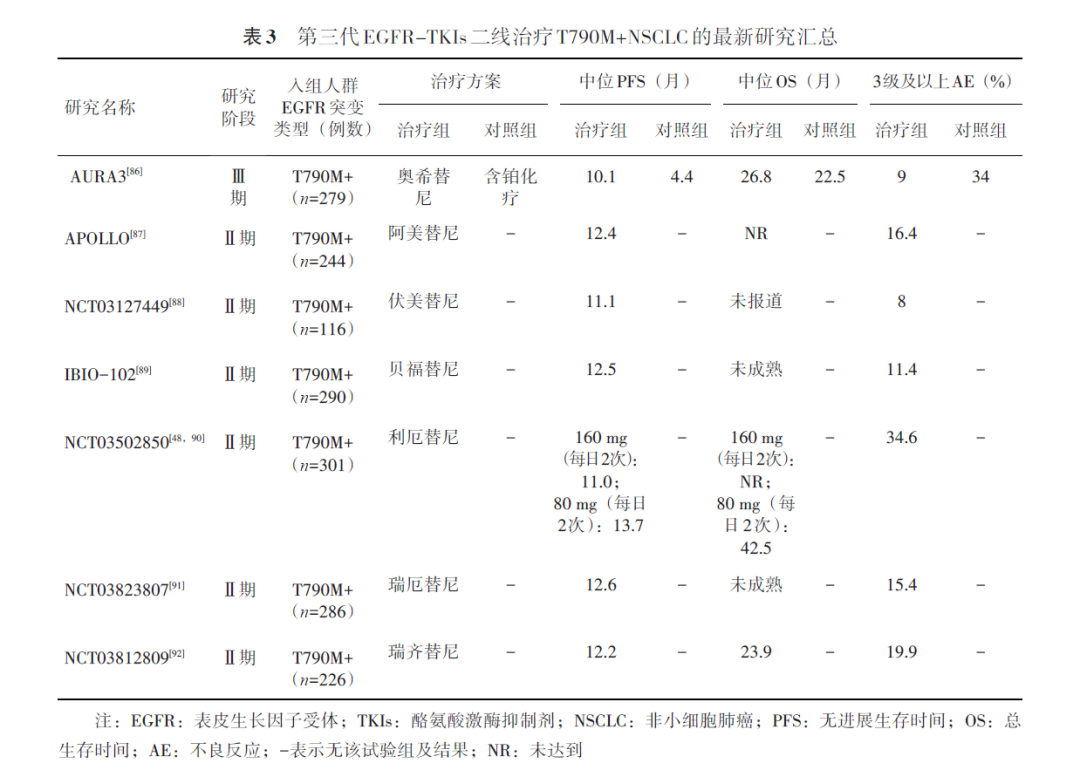
(1)旁路激活:对于EGFR非依赖性的其他耐药机制,如MET扩增、HER2突变,RET融合,KRAS突变等,推荐明确耐药机制后使用相应的靶向治疗。奥希替尼一线治疗耐药后发生MET扩增的比例约为7%~15%,二线或后线治疗发生MET基因异常的比例约为9.8%~30%,MET-TKIs +奥希替尼在Ⅱ期临床研究中ORR超过40%(表4);在一项c-MET ADC(Teliso-V)+奥希替尼用于奥希替尼治疗失败后c-MET过表达的非鳞NSCLC临床Ⅰb期研究(NCT02099058)中,19例可评估疗效患者ORR达58%。
SACHI研究是一项在中国开展的开放标签、随机对照、多中心Ⅲ期临床研究(NCT05015608),旨在评估奥希替尼+赛沃替尼(联合治疗组)对比铂类化疗(化疗组)用于EGFR-TKIs一线治疗进展后伴MET扩增局部晚期或转移性EGFR突变NSCLC的疗效及安全性。结果显示,ITT人群中,联合治疗组由研究者评估的中位PFS显著优于化疗组(分别为8.2和4.5个月,HR=0.34,95%CI:0.23~0.49,P<0.000 1);对于既往接受过第一代或第二代EGFR-TKIs治疗的患者,联合治疗组由研究者评估的中位PFS依旧显著优于化疗组(分别为9.8和5.4个月,HR=0.34,95%CI:0.21~0.56,P<0.000 1);由IRC评估的PFS获益与研究者评估一致(ITT人群:HR=0.40,P<0.000 1;既往第一、二代EGFR-TKIs经治人群:HR=0.47,P=0.001 7)。联合治疗组ORR为58%,而化疗组为34%;截至目前,OS数据尚未成熟。基于该研究结果,2025年1月2日NMPA已受理赛沃替尼联合奥希替尼用于治疗伴MET扩增的接受EGFR-TKIs一线治疗后疾病进展的EGFR突变阳性局部晚期或转移性NSCLC患者的新药上市申请,并纳入优先审评。
MARIPOSA-2 Ⅲ期随机对照研究的探索性分析显示,对于存在MET扩增(研究中定义拷贝数>2.2)的患者,埃万妥单抗联合化疗组(ACP,n=12)较单纯化疗组ORR获益显著(分别为67%和23%),中位PFS存在获益趋势(分别为4.4和3.1个月,HR=0.51,P=0.078),有待进一步大样本量研究进行确证。
对于其他,如HER2突变/扩增、ALK融合、RET融合、KRAS突变等可靶向分子机制的患者,经临床综合评估,也可尝试对应的靶向药物如德曲妥珠单抗、洛拉替尼、塞普替尼、氟泽雷塞等。
(2)组织学转化:大部分转化性SCLC保留了原有肺腺癌的突变基因(约占84%~88%)和SCLC的基因特征,如TP53和RB1的缺失突变。患者一旦发生 SCLC 转化,疾病往往进展较快,总体预后欠佳。根据CSCO中SCLC诊疗指南推荐,可选择标准SCLC化疗、EGFR-TKIs +局部治疗、SCLC化疗+ EGFR-TKIs靶向治疗方案。一项回顾性研究探索了免疫治疗在这类患者中的效果,免疫治疗组(阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇或阿替利珠单抗+依托泊苷+卡铂)与非免疫治疗组的中位OS差异有统计学意义(分别为20.2和7.9个月,P<0.01)。
3.未明确耐药机制患者的治疗策略
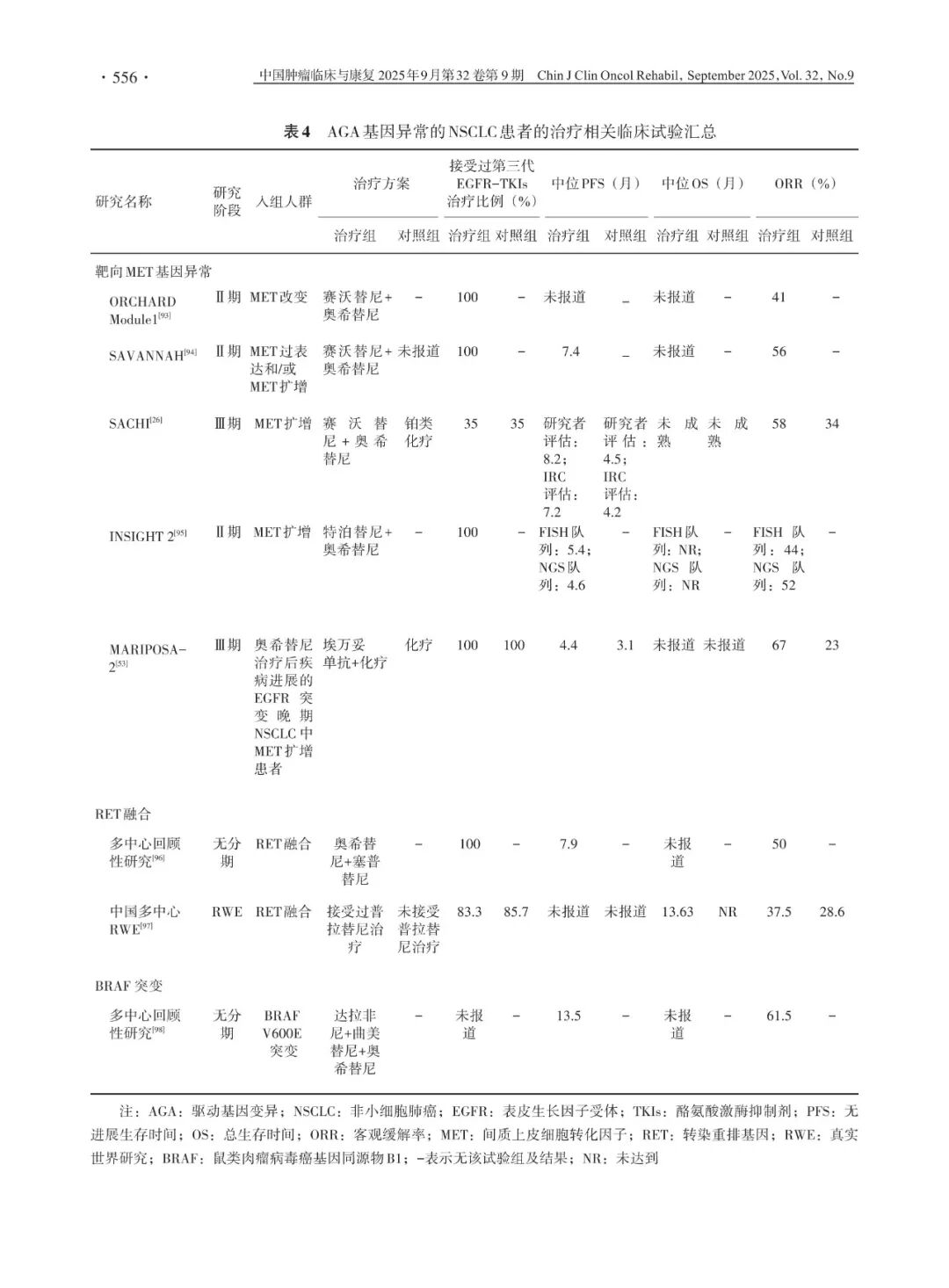
尽管EGFR-TKIs耐药后可通过再次活检来确定耐药机制,但仍有高达30%~50%的患者耐药机制不明。针对这类患者,临床上进行了诸多探索(表5)。
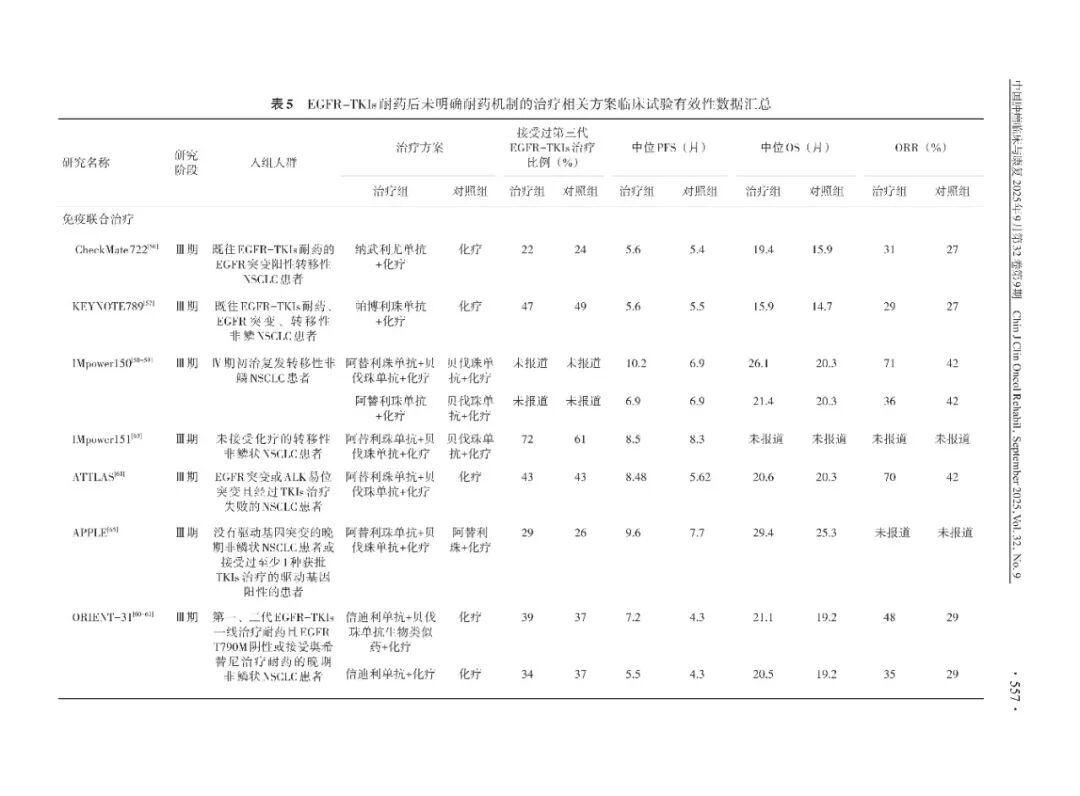
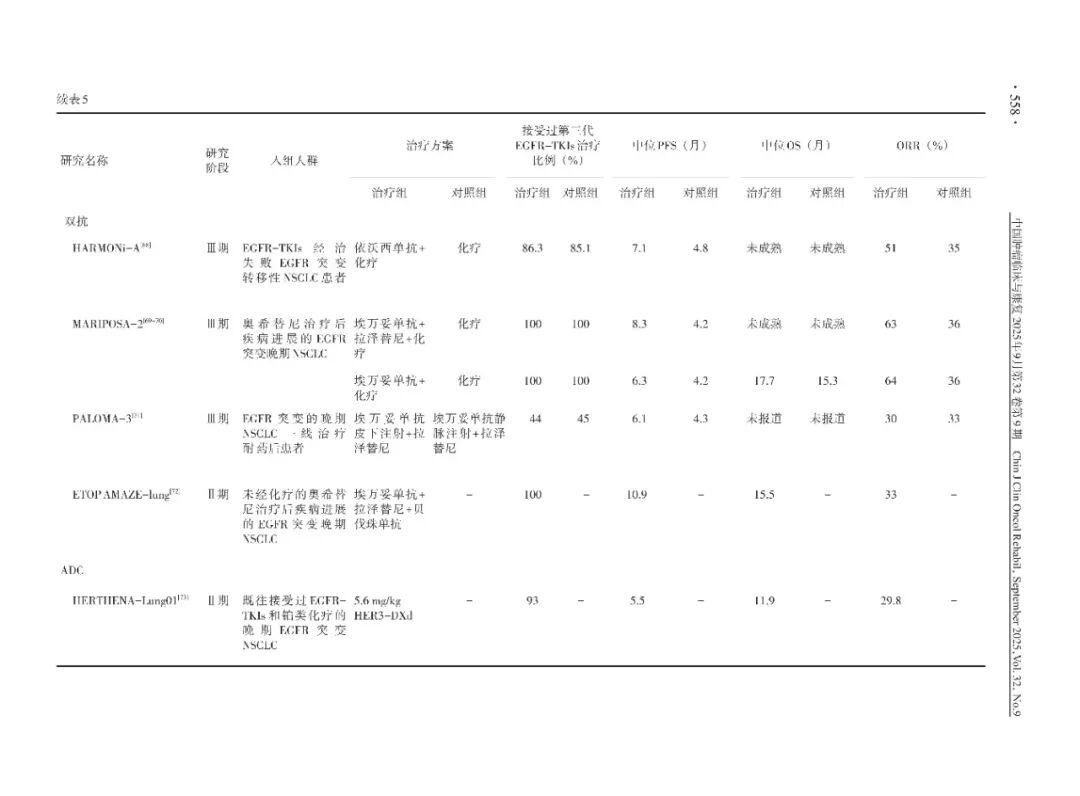
(1)免疫联合化疗:CheckMate 722研究是一项随机、对照、开放标签、Ⅲ期临床研究,旨在评估纳武利尤单抗联合含铂双药化疗治疗EGFR-TKIs耐药的转移性 NSCLC 患者的疗效和安全性,主要研究终点中位PFS无显著改善(中位PFS分别为5.6和5.4个月,HR=0.75;中位OS分别为19.4和15.9个月,HR=0.82)。然而,亚组分析显示,EGFR敏感突变和先前仅接受过一线EGFR-TKIs治疗的亚组中观察到PFS 获益的趋势(HR=0.64,95%CI:0.47~0.88);并且,PD-L1肿瘤比例评分(tumor proportion score,TPS)≥50%亚组6个月后PFS 获益趋势明显(HR=0.65,95%CI:0.36~1.15)。KEYNOTE-789 研究是一项随机、双盲、Ⅲ期临床研究,旨在探索帕博利珠单抗联合化疗与单纯化疗后线治疗EGFR-TKIs耐药的肺癌患者的疗效及安全性,该研究未达到PFS和OS主要终点(中位PFS分别为5.6和5.5个月,HR=0.80,P=0.012 2;中位OS分别为15.9和14.7个月,HR=0.84,P=0.036 2)。
ORIENT-31是一项中国多中心Ⅲ期研究,旨在评估免疫联合治疗在EGFR-TKIs耐药的NSCLC患者的疗效和安全性。研究显示,信迪利单抗+培美曲塞+顺铂(B组)和培美曲塞+顺铂作为对照组(C组)比较,中位PFS分别为5.5和4.3个月(HR=0.72), ORR分别为34.8%(95%CI:27.4~42.8)和29.4%(95%CI:22.4~37.1),提示免疫联合化疗相比化疗仍有获益趋势。
(2)免疫联合化疗及抗血管治疗:IMpower150研究是一项国际多中心、开放标签、随机对照Ⅲ期临床试验,旨在评估阿替利珠单抗联合贝伐珠单抗+卡铂+紫杉醇(ABCP方案)治疗非鳞NSCLC患者的疗效及安全性。该研究EGFR突变亚组结果显示,EGFR-TKIs治疗失败后的转移性NSCLC患者中,接受ABCP方案治疗与接受贝伐珠单抗+卡铂+紫杉醇(BCP方案)治疗相比,PFS和OS均有所改善,其中EGFR敏感突变人群的差异有统计学意义(中位PFS分别为10.2和6.9个月,HR=0.61;中位OS分别为NE和18.7个月,HR=0.61)。
ORIENT-31结果显示,信迪利单抗+贝伐珠单抗生物类似药+培美曲塞+顺铂(A组)、培美曲塞+顺铂(C组)的中位PFS分别为7.2和4.3个月,信迪利单抗联合贝伐珠单抗及化疗显著降低疾病进展或死亡风险49%(HR=0.51,95%CI:0.39~0.67),达到试验预设终点。PFS亚组分析显示,相比C组,A组中脑转移患者获益更多(HR=0.57)。此外,T790阴性、既往仅EGFR-TKIs一线治疗的人群获益更多。C组患者化疗进展后46%(74/162)的患者接受了免疫治疗,接受免疫治疗较非接受免疫治疗显著延长了患者OS(中位OS分别为16.7和7.8个月,HR=0.46,95%CI:0.30~0.71,P=0.001)。基于该研究结果,NMPA批准信迪利单抗联合贝伐珠单抗及化疗用于EGFR-TKIs治疗失败的EGFR突变的局部晚期或转移性EGFR突变阳性的非鳞NSCLC。
其他免疫治疗联合贝伐珠单抗及化疗的研究中,IMpower151研究是一项在中国开展的Ⅲ期随机对照研究,评估了ABCP与BCP一线治疗转移性非鳞NSCLC的疗效和安全性,结果显示,ABCP方案在EGFR突变转移性NSCLC患者中并无PFS获益。ATTLAS研究是一项在韩国开展的多中心、开放标签、Ⅲ期随机试验,评估阿替利珠单抗联合贝伐珠单抗和化疗治疗EGFR突变或ALK易位NSCLC的疗效和安全性,结果显示,既往TKIs治疗失败的患者中,ABCP方案较PC方案的PFS有显著改善(HR=0.62,P=0.004),但2组OS差异无统计学意义,需要更长时间的随访。APPLE研究是一项在日本进行的多中心、开放标签、随机Ⅲ期临床研究,旨在探索在程序性死亡受体1(programmed death-1,PD-1)或PD-L1和铂双药化疗中加入贝伐珠单抗治疗晚期非鳞状NSCLC的疗效。研究结果表明,阿替利珠单抗联合贝伐珠单抗和化疗(APPB组)对比阿替利珠单抗联合化疗(APP组),其中在驱动基因阳性亚组患者中,APPB组较APP组主要研究终点PFS显著改善(中位PFS分别为9.7和5.8个月,HR=0.67),并显示OS大幅提升的趋势(中位OS分别为32.0和20.8个月,HR=0.63)。
关于免疫检查点抑制剂治疗相关的生物标志物中,有研究显示,PD-L1表达可能和原发耐药相关,在未经治疗的敏感EGFR突变肺腺癌患者中,较高水平的PD-L1表达与对EGFR-TKIs治疗的原发性耐药率较高相关;该研究中有16例患者PD-L1 TPS≥50%,其中15例患者对EGFR-TKIs治疗产生原发性耐药,剩余1例患者对EGFR-TKIs治疗产生部分缓解,但PFS仅为4.4个月,这提示PD-L1阳性可能是获益优势生物标志物。一项纳入1 741例EGFR突变患者的荟萃分析亚组分析提示,与19DEL、T790M阳性,既往使用过两线靶向治疗的患者相比,L858R突变(HR=0.52,95%CI:0.37~0.72)、T790M突变阴性(HR=0.50,95%CI:0.37~0.72),既往仅使用一线EGFR-TKIs治疗(HR=0.47,95%CI:0.34~0.65)的患者更能够从免疫联合治疗中获益。还有回顾性研究分析了对第一、二代EGFR-TKIs产生耐药性后接受抗PD-1或PD-L1免疫治疗的58例晚期NSCLC患者,TKIs治疗阶段的PFS<10个月的患者免疫治疗后PFS显著延长(中位PFS分别为15.1和3.8个月,HR=0.26,P=0.000 2),ORR也更高(分别为31.8%和10.0%,P=0.04),提示EGFR-TKIs既往治疗短(<10个月)的患者可能使用免疫治疗获益更多。
(3)双抗:HARMONi-A研究是一项随机、双盲、多中心、Ⅲ期研究,旨在评估依沃西单抗联合化疗与单独化疗在EGFR-TKIs耐药的EGFR突变晚期或转移性非鳞NSCLC的疗效和安全性。研究共纳入320例患者(依沃西单抗联合化疗160例、化疗160例),其中脑转移比例分别为21.7%和23.0%。结果显示,相比化疗,依沃西单抗联合化疗组PFS获益显著(中位PFS分别为7.06和4.8个月,HR=0.46,95%CI:0.34~0.62,P<0.001),各亚组PFS获益情况与整体获益趋势一致(中位OS分别为17.1和14.5 个月,HR=0.80)。基于该研究,NMPA批准依沃西单抗联合化疗用于EGFR-TKIs治疗失败的EGFR突变阳性的局部晚期或转移性非鳞NSCLC。
MARIPOSA-2研究是一项双盲、随机对照Ⅲ期研究,旨在探索埃万妥单抗联合卡铂和培美曲塞±拉泽替尼治疗(ACP-L或CP方案)奥希替尼治疗后疾病进展的EGFR突变晚期NSCLC患者的疗效和安全性,结果显示与单纯化疗相比,ACP-L和ACP方案的中位PFS分别为8.3、6.3和4.2个月,分别降低了56%和52%的疾病进展或死亡风险;第2次中期分析显示,与单纯化疗相比,ACP方案组的中位OS有所改善(分别为17.7和15.3个月,HR=0.73,P=0.039)。基于MARIPOSA-2研究结果,美国食品药品监督管理局(Food and Drug Administration,FDA)批准埃万妥单抗联合卡铂和培美曲塞用于治疗接受EGFR- TKIs治疗后发生疾病进展的EGFR 19号外显子缺失(Ex19del)或L858R置换突变的局部晚期或转移性NSCLC成年患者。2025年4月25日NMPA批准埃万妥单抗与卡铂和培美曲塞联合用于治疗携带Ex19del或21号外显子L858R置换突变且在EGFR-TKIs治疗期间或之后疾病进展的局部晚期或转移性非鳞状NSCLC。
PALOMA-3研究是一项随机、开放标签的Ⅲ期研究,旨在评估在奥希替尼和化疗后出现进展的EGFR突变晚期或转移性NSCLC患者中,皮下埃万妥单抗联合拉泽替尼与静脉注射埃万妥单抗和拉泽替尼相比的药代动力学(pharmacokinetics,PK)、疗效和安全性。研究结果显示,主要终点PK方面,皮下注射组和静脉注射组在C2D1峰谷血药浓度的几何平均比率(geometric mean ratio,GMRs)为 1.15(90%CI:1.04~1.26);C4D1峰谷血药浓度的GMRs为1.42(90%CI:1.27~1.61);AUCD1~D15的GMRs为1.03(90%CI:0.98~1.09),研究结果符合非劣效标准。次要终点方面,皮下注射组和静脉注射组的ORR分别为30.1%和32.5%(RR=0.92,P=0.001),符合非劣效标准;皮下注射组较静脉注射组中位PFS有良好的获益趋势(分别为6.1和4.3个月,HR=0.84,P=0.20),且显著延长了患者的OS(HR=0.62,95%CI:0.42~0.92,未经校正的P=0.02)。基于该研究,埃万妥单抗皮下注射剂型已申请其静脉剂型所覆盖的已批准和已经提交的所有适应证,NMPA于2024年9月25日受理。
ETOP AMAZE-lung研究是一项前瞻性、国际多中心、单臂Ⅱ期研究,旨在评估埃万妥单抗(体重<80 kg:1 750 mg,每3周1次;≥80 kg:2 100 mg,每3周1次)、拉泽替尼(240 mg/d)和贝伐珠单抗(15 mg/kg,每3周1次)联合方案在未经化疗的EGFR突变(Ex19del /21号外显子L858R突变)晚期NSCLC患者奥希替尼耐药后的疗效。结果显示,中位PFS为10.9个月(95%CI:5.3至NE);中位OS为15.5 个月(95%CI:12.3至NE);12周时ORR为33%,达到预设成功标准(>20%)。
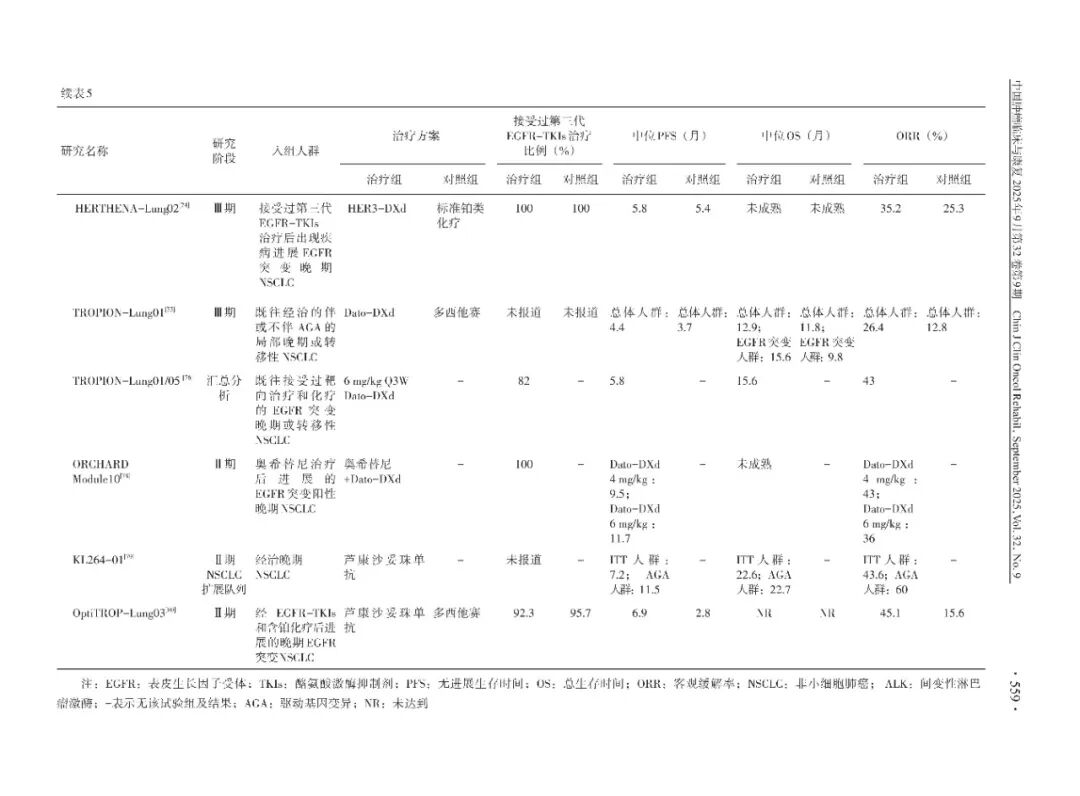
(4)ADC:HERTHENA-Lung01研究是一项全球性、多中心、开放性、双臂Ⅱ期试验,旨在评估Patritumab deruxtecan(HER3-DXd)用于第三代EGFR-TKIs和铂类药物治疗期间或治疗后出现疾病进展的EGFR突变局部晚期或转移性NSCLC患者的治疗。研究共入组225例患者,结果显示,ORR 为 29.8%(95%CI:23.9~36.2),包括1例完全缓解和66例部分缓解,中位缓解持续时间为6.4个月(95%CI:4.9~7.8)。另一项全球性、多中心、随机、开放标签Ⅲ期临床试验(HERTHENA-Lung 02),旨在评估Patritumab deruxtecan(HER3-DXd)与培美曲塞和铂类用于接受第三代EGFR-TKIs治疗失败后的局部晚期或转移性EGFR突变NSCLC患者的有效性和安全性。结果显示,HER3-DXd组的中位PFS为5.8个月,化疗组为5.4个月,差异有统计学意义(HR=0.77,P=0.011),HER3-DXd组ORR高于化疗组(分别为35.2%和25.3%),2组OS数据尚未成熟。
TROPION-Lung01研究是一项全球性、随机、多中心、开放标签的Ⅲ期临床试验,旨在评估Datopotamab deruxtecan(Dato-DXd)对比多西他赛在既往至少接受过一种治疗、伴或不伴驱动基因阳性的局部晚期或转移性NSCLC患者的有效性和安全性。研究共纳入605例患者,其中EGFR突变患者占比6.4%。结果显示,Dato-DXd后线治疗较多西他赛可带来有统计学意义的PFS获益(中位PFS分别为4.4和3.7 个月,HR=0.75,P=0.004);亚组分析发现,Dato-DXd 治疗对伴驱动基因变异患者PFS获益更为明显(HR=0.38)。非鳞癌亚组中位PFS具有显著获益,OS有获益趋势。
TROPION-Lung05和TROPION-Lung01汇总分析既往接受过EGFR-TKIs靶向治疗和铂类化疗的EGFR突变的晚期或转移性NSCLC患者共计117例,接受Dato-DXd 6 mg/kg治疗。结果显示,经确认的ORR为43%(95%CI:34%~52%),中位缓解持续时间(duration of response,DoR)为7.0个月(95%CI:4.2~9.8),中位PFS为5.8个月,中位OS为15.6个月。基于该数据,FDA于2025年6月23日加速批准Datopotamab deruxtecan用于治疗既往接受过EGFR-TKIs和铂类化疗治疗的晚期或转移性EGFR突变NSCLC成年患者。
ORCHARD研究是一项开放标签非随机、多中心、多药物、生物标志物导向的Ⅱ期平台研究,其中模块10是评估奥希替尼一线治疗进展后使用奥希替尼联合Dato-DXd(分为2个队列,剂量分别为4和6 mg/kg,每3周1次)治疗局部晚期或转移性EGFR经典突变(Ex19del/L858R)NSCLC患者的疗效。结果显示,4和6 mg/kg组ORR分别为43%和36%,中位PFS分别为9.5个月(95%CI:7.2~9.8)和11.7个月(95%CI:8.3至NC),DoR为9个月患者分别为15%和64%。
Ⅰ~Ⅱ期KL264-01研究旨在评估芦康沙妥珠单抗(TROP2 ADC)对NSCLC等重度经治晚期实体瘤患者的疗效和安全性,结果显示,EGFR突变耐药患者ORR达60.0%,中位PFS可达11.1个月。一项全球性、多中心、随机、开放标签Ⅱ期临床试验(OptiTROP-Lung03),旨在评估芦康沙妥珠单抗对比多西他赛用于经EGFR-TKIs和含铂化疗治疗(序贯或联合)失败后的局部晚期或转移性EGFR突变NSCLC患者的有效性和安全性。结果显示,芦康沙妥珠单抗缓解获益显著优于多西他赛(主要终点采用由BIRC评估的ORR,分别为45.1%和15.6%,P=0.000 4);芦康沙妥珠单抗PFS获益也显著优于多西他赛(中位PFS由BIRC评估,分别为6.9和2.8个月,HR=0.30,P<0.000 1);2组的中位OS均未达到,12个月总生存率分别为72.8%和54.3%,校正交叉治疗影响后,死亡风险降低达64%(HR=0.36)。基于该研究,NMPA于2025年3月4日批准芦康沙妥珠单抗用于治疗经EGFR-TKIs和含铂化疗治疗后进展的EGFR基因突变阳性的局部晚期或转移性非鳞NSCLC。该适应证是基于替代终点结果给予的附条件批准。
EGFR-TKIs 耐药后具体推荐的治疗方案见图1。
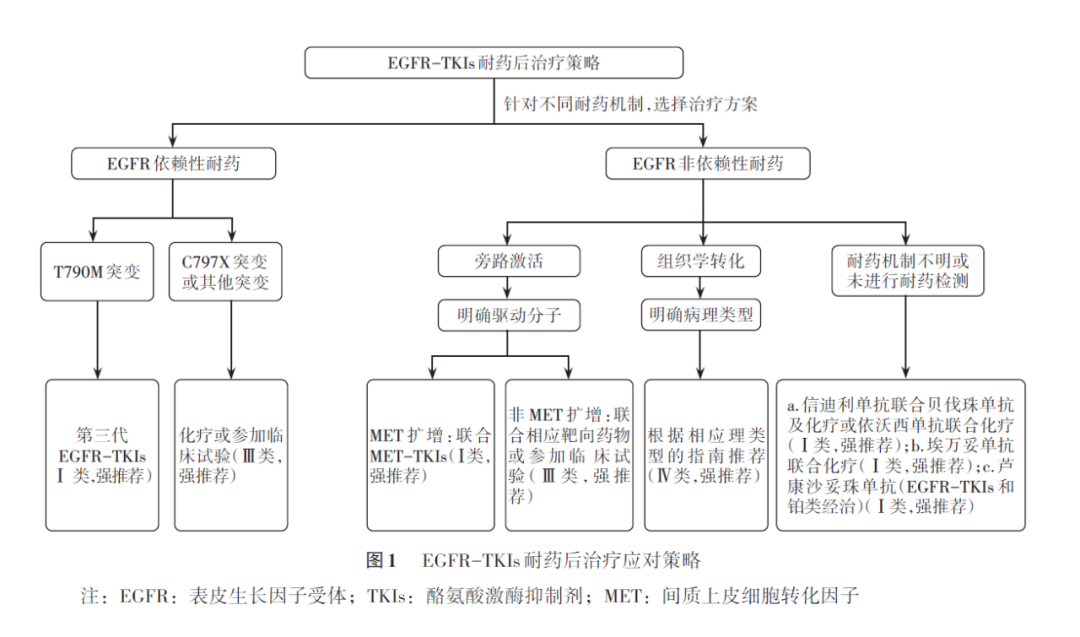
共识推荐4:耐药机制分为EGFR依赖性耐药、EGFR非依赖性耐药和耐药机制不明,不同的机制应给予相应的治疗建议。(证据级别:Ⅰ类;推荐等级:强推荐)
共识推荐5:针对第一、二代EGFR-TKIs治疗进展后产生的T790M突变,建议选择第三代EGFR-TKIs。(证据级别:Ⅰ类;推荐等级:强推荐)
共识推荐6:对于第三代EGFR-TKIs治疗后产生的C797X突变等其他EGFR依赖性突变,目前后续治疗的循证医学证据尚不足,可考虑以化疗为基础的治疗或参加临床试验。(证据级别:Ⅲ类;推荐等级:强推荐)
共识推荐7.1:对于旁路激活的非EGFR依赖性耐药,如检测到MET扩增,建议选择MET-TKIs联合EGFR-TKIs。(证据级别:Ⅰ类;推荐等级:强推荐)
共识推荐7.2:对于旁路激活的非EGFR依赖性耐药,如检测到非MET扩增的情况,比如RET融合、BRAF V600E等,可尝试联合相应靶向药物或参加临床试验。(证据级别:Ⅲ类;推荐等级:强推荐)
共识推荐8:对于组织学转化的非EGFR依赖性耐药,可以在活检明确病理类型后,根据相应病理类型的指南推荐选择相应治疗方案,或选择以化疗为基础的治疗、EGFR-TKIs+局部治疗等。(证据级别:Ⅳ类;推荐等级:强推荐)
共识推荐9:对于耐药机制不明或未进行耐药检测的患者,可选择信迪利单抗联合贝伐珠单抗及含铂化疗、依沃西单抗联合含铂化疗,埃万妥单抗联合含铂化疗等。对于免疫不耐受的患者,也可选择含铂化疗或化疗联合贝伐珠单抗(非鳞癌)。对于EGFR-TKIs和含铂治疗后进展的患者,可考虑芦康沙妥珠单抗治疗。(证据级别:Ⅰ类;推荐等级:强推荐)
六、耐药后随访
对于接受EGFR-TKIs治疗耐药后无临床症状或症状稳定的患者,建议每2~3个月随访1次;随访项目包括询问症状、体格检查、血清学肿瘤标志物及胸腹部增强 CT 检查,怀疑伴有脑、骨转移者需要复查脑MRI和/或全身骨扫描;对于临床出现新的症状和/或症状加重者,应立即随诊。临床医生可根据患者的具体情况和需要,决定是否进行额外的化验及影像学检查。
APPLE试验是一项在初治EGFR突变的NSCLC患者中开展的随机、非比较、开放标签、三臂的Ⅱ期研究,探索通过ctDNA监测血浆 EGFR T790M判断吉非替尼转换至奥希替尼最佳时机的可行性。该试验证实连续ctDNA T790M 监测至疾病进展后换用奥希替尼(B组)较一线使用奥希替尼直至按照实体瘤疗效评价标准1.1版(Response Evaluation Criteria in Solid Tumors version 1.1,RECIST 1.1) 标准评估出现疾病进展(A组),18个月时的无进展生存率分别为60.5%和51.1%。AURA3研究表明,第3周时ctDNA EGFR突变清除患者较未清除患者的PFS获益(中位PFS分别为10.9和5.7个月),FLAURA研究也显示类似的结果(ctDNA EGFR突变清除患者较未清除患者中位PFS分别为19.8和11.3个月)。
近年来,肺癌适应性治疗的概念从放疗领域逐步拓展到肺癌综合治疗的其他方面。适应性治疗利用生物标志物精准选择患者,在标准治疗基础上实施降阶或升阶治疗,或可探索药物假期策略,以期获得更佳的疗效、更高的生活质量和/或更好的成本效益适应证治疗。目前关于肺癌适应性治疗的标志物如ctDNA-分子残留病灶(molecular residual disease,MRD)集中在局部根治性治疗后的动态监测临床场景中。晚期肺癌治疗中面对长期治疗或者联合治疗可能引起的不良反应时,利用有效、合理的生物标志物和临床特征进行人群筛选是重要环节。如旨在探索是否在标准的第一代EGFR靶向药基础上升阶联合贝伐珠单抗的CTONG 1509研究结果显示,此升阶模式在EGFR L858R突变(HR=0.50)和脑转移(HR=0.48)的患者群体获益更大。一项旨在探索TKIs治疗后局部巩固治疗对寡转移的NSCLC疗效的探索性概念验证研究结果显示,ctDNA检测阳性或CEA升高重新开始TKIs治疗,如果随访期间所有指标均阴性就停止治疗。该研究中60例患者的中位停药时间为9.2个月,中位PFS为18.4个月,75%的患者可以从停药策略中获益,停药进展后用原药再治疗的有效率达到96%。以上研究证据初步提示,对于EGFR突变的晚期NSCLC在经过系统治疗后,影像学无可见或无代谢肿瘤病灶时,可考虑药物假期,在生物标志物指导下实行适应性治疗。
共识推荐10:推荐定期进行影像学检查,对患者进行个体化随访,根据疾病进展和治疗反应调整治疗方案。鼓励开展基于分子标志物指导治疗的临床研究,探索适应性治疗模式(证据级别:Ⅲ类;推荐等级:强推荐)
七、标准化质量控制
随着治疗时间的延长,耐药性是一个不可避免的挑战,标准化质量控制能够确保治疗的一致性和可靠性,减少治疗过程中的变异性,提高治疗效果。EGFR-TKIs耐药后应对策略相关标准化质量控制体系应覆盖治疗全流程的关键环节,即耐药后分子检测、耐药后治疗方案选择及耐药后随访。
1.耐药后分子检测
分子检测有助于明确耐药机制,耐药机制的精准识别是制定后续治疗策略的核心依据,需通过标准化流程确保检测结果的可靠性及临床可操作性。耐药后分子检测可从样本采集、检测技术选择和报告解读等方面进行标准化质量控制。
(1)样本采集标准化:在EGFR-TKIs耐药后的检测中,样本采集需遵循标准化流程。目前国内外指南均推荐优先使用甲醛固定-石蜡包埋组织样本进行肿瘤基因检测,国内外指南均推荐在无法进行组织和细胞学检测(样本不可及或经评估不合格)的情况下使用体液样本。样本采集需确保组织样本量充足、固定及时、保存和运输条件规范,避免污染和降解;体液样本则需注意采集量、保存温度及运输时间等要求。
(2)检测技术标准化:根据样本类型选择合适的检测方法,选择批准的或经过认证的检测试剂及仪器设备进行检测,遵循各种检测方法的标准操作程序,确保结果准确性和可重复性。建立全面的质量管理体系,涵盖人员培训与资质管理、设备校准与维护、样本全流程标准化管理、检测过程实时监控,以及定期质量评估等关键环节,确保检测结果的准确性和可靠性。
(3)报告解读标准化:优先报告具有明确治疗靶向性的驱动变异,当检出多基因共存变异时,结合克隆进化模型判断耐药机制优先级。制定统一的结果解读标准,避免误读或过度解读。
2.耐药后治疗方案选择
在EGFR-TKIs耐药后的治疗管理中,应依据临床指南和患者个体情况,制定标准化的药物选择与剂量方案,确保药物的储存、配制及给药过程严格规范。同时,建立完善的不良反应监测与报告机制,及时规范处理药物不良反应相关问题。在患者教育方面,应提供详尽的用药指导,确保患者正确使用药物,并定期评估药物疗效,必要时调整治疗方案。随着抗肿瘤新药研发的加速,EGFR-TKIs耐药后的治疗方案选择越来越多,面对EGFR-TKIs耐药后的患者,单一学科往往难以提供全面有效的治疗方案,需要多学科团队诊疗(multi-disciplinary treatment,MDT),建立由肿瘤内科、放疗科、病理科、影像科等多学科组成的团队,确保各环节质量控制措施有效实施。
3.耐药后随访
在EGFR-TKIs耐药后的治疗管理中,应建立标准化随访流程,包括统一的随访时间、频率和内容。使用标准化数据记录表格或数字化工具以确保信息完整、准确。可组建专业随访团队,定期组织培训、分享经验,持续优化随访流程。同时,建立定期核查机制以确保数据真实性和完整性,并通过提醒、教育等方式提高患者依从性,监测患者的疾病进展和治疗反应,及时发现并处理可能出现的复发或转移情况。
八、展望
EGFR-TKIs耐药是阻碍晚期EGFR突变NSCLC患者长期生存的主要原因之一。目前随着对EGFR-TKIs耐药机制的深入理解,未来会有更多针对耐药后治疗的临床试验和新药物不断涌现,为该类患者的临床管理提供更多参考和指导。
本共识仅代表参与编写及讨论专家的观点。共识内容基于现有循证医学证据,仅为临床实践提供参考,不具有法律约束性质。随着药物研发的进展和更多相关临床试验的展开,循证等级更高的证据出现时,本共识可根据新的临床证据进行动态更新。
专家组顾问:王洁(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)、陆舜(上海市胸科医院肿瘤科 上海市肺部临床医学中心)
专家组组长:王志杰(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)、李子明(上海市胸科医院)、褚倩(华中科技大学同济医学院附属同济医院胸部肿瘤科)
专家组成员(按姓氏汉语拼音字母排序):艾星浩(上海交通大学附属胸科医院肿瘤内科)、陈凯(苏州大学附属第一医院肿瘤科)、崔久嵬(吉林大学第一医院肿瘤科)、董晓荣(华中科技大学附属协和医院肿瘤内科)、杜瀛瀛(安徽医科大学第一附属医院肿瘤内科)、段建春(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)、方文峰(中山大学肿瘤防治中心内科)、方勇(浙江大学医学院附属邵逸夫医院肿瘤科)、郭其森(山东省肿瘤医院 山东第一医科大学附属肿瘤医院呼吸内科)、韩琤波(中国医科大学附属盛京医院肿瘤内科)、胡洁(复旦大学附属中山医院呼吸与危重症医学科)、黄鼎智(天津医科大学肿瘤医院肿瘤内科)、李娟(四川省肿瘤医院肿瘤内科)、梁文华(广州医科大学附属第一医院肿瘤科)、林根(首都医科大学附属北京胸科医院肿瘤中心)、刘哲峰(解放军总医院第三医学中心肿瘤内科)、吕镗烽(东部战区医院呼吸科)、马芳(中南大学湘雅二医院肿瘤科)、沈波(江苏省肿瘤医院 南京医科大学附属肿瘤医院内科)、宋正波(浙江省肿瘤医院 Ⅰ期临床试验病房)、王慧娟(郑州大学附属肿瘤医院 河南省肿瘤医院呼吸内科)、王佳蕾(复旦大学附属肿瘤院肿瘤内科)、王俊(山东省千佛山医院肿瘤科)、王启鸣(河南省肿瘤医院呼吸内科)、邬麟(中南大学湘雅医学院附属肿瘤医院 湖南省肿瘤医院胸部内科)、徐佳晨(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)、徐燕(北京协和医院呼吸内科)、薛建新(四川大学华西医院胸部肿瘤科)、姚煜(西安交通大学第一附属医院肿瘤内科)、叶峰(厦门大学附属第一医院肿瘤内科)、于雁(哈尔滨医科大学附属肿瘤医院呼吸肿瘤内科)、于壮(青岛大学附属医院肿瘤内科)、张晓菊(河南省人民医院呼吸内科)、赵明芳(中国医科大学附属第一医院肿瘤内科)、周建娅(浙江大学医学院附属第一医院呼吸科)、卓明磊(北京大学肿瘤医院胸部肿瘤内一科)
执笔人:徐佳晨(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)、李子明(上海市胸科医院)、褚倩(华中科技大学同济医学院附属同济医院胸部肿瘤科)、王志杰(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
利益冲突 所有作者声明无利益冲突
来源:中国肿瘤临床与康复杂志